Что значит опухолевые клетки не экспрессируют
Серологические опухолевые маркеры в вопросах и ответах
Серологические опухолевые маркеры в вопросах и ответах
проф. Сергеева Н.С., к.б.н. Маршутина Н.В.
Что такое серологические опухолевые маркеры?
Какую информацию дают анализы опухолевых маркеров?
Возрастание в крови уровней опухолевых маркеров часто указывает на развитие опухолевого процесса, дает дополнительную информацию о степени его распространенности (стадии болезни) и, что особенно важно, об ответе на лечение, т.е. эффективности проведенной терапии. После окончания первичного лечения периодическое исследование опухолевых маркеров часто дает возможность заподозрить развитие рецидива опухолевого процесса раньше традиционно используемых в онкологии методов диагностики.
Для больных с какими злокачественными новообразованиями исследуют опухолевые маркеры?
Известны опухолевые маркеры рака яичников, тела и шейки матки, молочной железы, предстательной железы, органов желудочно-кишечного тракта, легкого других злокачественных новообразований.
Наиболее часто используемые серологические опухолевые маркёры
Серологические опухолевые маркеры
Рак молочной железы
СА 15-3, РЭА, СА 19-9, НЕ4, СА 72-4 (гормоны: пролактин, эстардиол)
СА 125, НЕ4, СА 72-4, СА 19-9
СА 125, НЕ4, СА 19-9, РЭА
Рак поджелудочной железы
Рак мочевого пузыря
Tu M2-PK, SCC, СА 125, НЕ4
Рак предстательной железы
ПСАобщ, ПСАсвоб/ ПСАобщ., [-2] проПСА, индекс здоровья простаты (ИЗП), НЕ4
Рак щитовидной железы:
Тиреоглобулин (ТГ), антитела к ТГ, ТТГ
Метастазы в костях
Хромогранин А, 5-ГИУК, гастрин 17
Если у человека повышен тот или иной опухолевый маркер, означает ли это диагноз «рак»?
Высокие уровни одних маркеров подтверждают подозрения, других- служат основанием для дополнительного обследования, так как концентрации маркеров могут повышаться и при доброкачественных опухолях и воспалительных заболеваниях. Поэтому, если у человека содержание опухолевого маркера превышает норму, следует провести дообследование для установления причины этого и прежде всего исключить наличие злокачественной опухоли. Кроме того, рекомендуется повторить анализ через 1-1,5 месяца. В целом же интерпретацией анализов опухолевых маркеров как и результатов других диагностических методов, занимается врач, имеющий специальную подготовку.
Таким образом, повышение маркера — это не всегда злокачественный процесс, но всегда патологический процесс, который требует дообследования.
Всегда ли повышен опухолевый маркер при наличии злокачественной опухоли?
В ряде случаев у больных со злокачественными заболеваниями уровень маркеров может оставаться в пределах нормы. Это означает, что у отдельных пациентов опухолевые клетки не выделяют в кровь данный маркер, что еще раз подтверждает необходимость использования опухолевых маркеров в комплексе с другими диагностическими методами. Маркеры могут оставаться в пределах нормы и при начальных стадиях опухолевого процесса, так как объем опухоли в этих случаях мал. В то же время для опухолей каждого типа подобрано несколько опухолевых маркеров. Поэтому для многих пациентов с установленным диагнозом злокачественной опухоли удается найти маркер, уровень которого повышен до начала лечения, и использовать этот маркер для мониторинга течения болезни.
Что дает регулярное определение содержания опухолевых маркеров у онкологических больных в процессе лечения и впоследствии при наблюдении за больными?
Оценка содержания опухолевых маркеров в крови дает возможность лечащему врачу получить дополнительную информацию, позволяющую, во-первых, оценить эффективность проведенного лечения и назначить, при необходимости, иную схему терапии. Во-вторых, уровни опухолевых маркеров учитывают и при решении вопроса о прекращении или продолжении химиотерапии больных. Особо следует отметить, что при наблюдении за больными после окончания лечения опухолевые маркеры часто позволяют уловить начало возобновления болезни до ее проявления и раньше других методов диагностики.
Какие опухолевые маркеры и для каких больных наиболее широко используются сегодня?
В настоящее время одним из наиболее успешно используемых в онкологической клинике опухолевых маркеров является простат специфический антиген (ПСА) В США, например, выполняется программа обязательного ежегодного исследования ПСА у всех мужчин старше 45 лет, направленная на выявление начальных форм рака предстательной железы. В нашей стране многие врачи – урологи также назначают пациентам анализ на ПСА. Результаты анализа позволяют выделить группу мужчин для дообследования и, таким образом, выявить рак предстательной железы в ранней стадии, когда терапия приводит к полному излечению. ПСА, кроме того, успешно используется для контроля эффективности лечения как у больных раком, так и пациентов, страдающих аденомой предстательной железы. С помощью ПСА выявляют также начало возобновления заболевания, поэтому уровень этого маркера следует периодически определять у пациентов после проведенного лечения.
Поскольку ПСА может быть повышен не только при раке предстательной железы, но и при доброкачественных процессах в простате (аденома, простатит), существуют методы оценки разных фракций ПСА, что позволяет проводить дифференциальную диагностику для этих заболеваний.
До 80% больных раком яичников имеют повышенный уровень СА125, который значительно снижается в процессе лечения. Это позволяет использовать данный маркер для оценки эффективности лечения рака яичников. При возобновлении опухолевого процесса концентрация СА 125 в крови начинают возрастать за 2-6 мес. до его клинического проявления. На этом свойстве белка СА125 основан метод динамического наблюдения больных раком яичников с целью раннего выявления рецидивов опухоли.
В то же время необходимо знать, что уровни СА125 могут несколько повышаться при доброкачественных опухолях яичников, воспалительных заболеваниях и эндометриозе (в меньшем проценте случаев и меньшей концентрации, чем при раке яичников), что позволяет использовать данный опухолевый маркер для мониторинга пациенток с этими заболеваниями.
В последнее десятилетие в арсенале онкогинекологов появился новый опухолевый маркер рака яичников – НЕ4 (human epididymis protein 4). Повышенные уровни белка НЕ4 обнаруживаются у 88,0% больных раком яичника. При этом НЕ4 значительно реже, чем СА125, повышен у пациенток с доброкачественными гинекологическими заболеваниями и практически не повышается при эндометриозе.
Комбинация НЕ4 с СА 125 позволяет улучшить чувствительность метода дифференциальной диагностики злокачественного и доброкачественного процесса в яичниках и, по мнению ряда авторов, является более точным предиктором злокачественного процесса при наличии у женщины образований в малом тазу. Это крайне важно для выработки адекватной тактики лечения таких пациенток на этапе диагностики.
Анализ данных по сочетанному использованию двух ОМ (СА 125 и НЕ4) в дифференциальной диагностике РЯ с использованием логистической регрессии позволил разработать алгоритм ROMA (risk of ovarian malignancy algorithm). ROMА учитывает концентрации онкомаркеров НЕ4 и СА 125, а также менопаузальный статус пациентки и позволяет рассчитать вероятность рака яичников, разделяя женщин с образованиями в малом тазу на группы с высоким и низким риском данного заболевания. Было показано, что значения ROMA ≥ 27,7% и ≥ 13,1% для женщины в постменопаузе и пременопаузе, соответственно, ассоциированы с высоким риском обнаружения раком яичников.
При колоректальном раке рекомендуется определять маркеры: РЭА, СА 19-9. Показано, что уровень РЭА на старте лечения коррелирует со стадией процесса, с продолжительностью безрецидивного после первичного лчения периода, а также с прогнозом течения опухолевого процесса.
Особенно высокий уровень обнаруживается у пациентов с метастазами в кости, печень, легкие и другие органы. Падение уровня РЭА после лечения является показателем его эффективности, вторичный подъем данного маркера свидетельствует о развитии рецидива и метастазов.
Маркером для мониторинга больных фолликулярным и папиллярным раком щитовидной железы является ТГ (тиреоглобулин). ТГ – гликопротеид коллоида щитовидной железы, предшественник тиреоидных гормонов.
Содержание ТГ в крови может повышаться не только при раке щитовидной железы, но и при тиреотоксикозе, токсической аденоме и тиреоидите. Поэтому по концентрации ТГ нельзя дифференцировать заболевания щитовидной железы. Определение уровня ТГ в крови показано, прежде всего, больным до и после удаления щитовидной железы по поводу рака в качестве контроля радикальности проведенной операции. Выявление ТГ в крови у больных без щитовидной железы свидетельствует о наличии в организме ткани щитовидной железы; при прогрессировании заболевания уровень этого белка возрастает.
Необходимо отметить, что определение ТГ следует проводить не ранее чем через 3 нед после пункционной биопсии щитовидной железы и через 3 мес после удаления органа по поводу рака щитовидной железы.
Таким образом, широко используемые в настоящее время тесты на опухолевые маркеры представляют собой информативные, простые в исполнении, доступные по цене, нетравматичные методы активного выявления злокачественных новообразований и наблюдения за онкологическими больными, позволяющие осуществлять оценку эффективности лечения и доклиническое выявление рецидива заболевания. Кроме того, исследовать опухолевые маркеры весьма полезно у лиц с повышенным онкологическим риском (наличие родственников, больных раком; работники вредных производств и др.) для раннего выявления онкологических заболеваний.
Когда не рекомендуется проводить исследования опухолевых маркеров?
Не рекомендуется исследовать маркеры при острых и обострении хронических заболеваний, а также после инвазивных диагностических процедур. В этих случаях можно получить ложноположительные результаты.
Может ли человек без назначения врача сдать анализ крови для определения конкретного опухолевого маркера?
Да. Это можно сделать и в нашем институте. Но еще раз хотим подчеркнуть, что грамотно назначить анализ и интерпретировать его результаты может только врач. Поэтому лучше до сдачи крови посоветоваться с врачом для решения вопроса о выборе опухолевых маркеров, наиболее информативных для конкретного пациента. В то же время мы не исключаем возможности, в частности, для мужчин, проявлять инициативу и самостоятельно сдавать анализ ПСА, а для женщин СА125.
Экспрессия маркеров опухолевого роста
Экспрессия маркеров опухолевого роста: HER 2 neu, Ki 67, P 53, как фактор влияния на метастазирование рака молочной железы в легкие
В.Н. Плохов, И.И. Андреяшкина*
Кафедра онкологии с курсом онкологии ВолгГМУ, Дорожная клиническая больница на ст. Саратов II ОАО «РЖД»*
В работе представлен анализ данных литературы и результатов собственных наблюдений авторов относительно выявления закономерностей экспрессии маркеров опухолевого роста HER 2 neu, Ki 67, P 53 при метастазировании рака молочной железы в легкие. Рассмотрено влияние гиперэкспрессии HER 2 neu на клинические варианты метастазирования рака молочной железы в легкие. Оценены изменения иммуногистохимических маркеров на фоне проведения полихимиотерапии.
Ключевые слова: рак молочной железы, метастазы в легкие, иммуногистохимические маркеры.
Expression of tumors growth markers her 2 neu, ki 67, p 53 as afactor affecting mammary cancer metastasizing into lungs
V.N. Plohov, I.I. Andreiashkina
The paper presents an analysis of literature data and results of authors own observations on the identification of patterns of expression of markers of tumor growth: HER 2 neu, Ki 67, P 53, with metastatic breast cancer in the lungs. The influence of overexpression of HER 2 neu in clinical variants of metastatic breast cancer in the lungs. Evaluate the changes of immunohistochemical markers on the background of the chemotherapy.
Key words: breast cancer, lung metastases, immunohistochemical markers.
При метастазировании рака молочной железы в легкие большое значение имеет учет факторов, предсказывающих эффект от лечения и прогноз течения заболевания [3, 6]. Для определения прогноза и выбора терапии при метастазах рака молочной железы в легкие важное значение имеют ряд молекулярных маркеров. Во многих исследованиях получены доказательства большого прогностического значения таких иммуногистохимических маркеров, как эпидермальный фактор роста HER 2 neu, тканевые маркеры пролиферации и апоптоза при раке молочной железы. Иммуногистохимическое исследование позволяет оценивать данные показатели в связи с клеточным циклом опухоли [2, 5, 8].
Знание иммуногистохимических маркеров как эпидермальный фактор роста HER 2 neu, тканевые маркеры пролиферации и апоптоза позволяют разработать оптимальную модель для оценки риска метастазирования рака молочной железы в легкие у отдельного больного и выбора метода лечения [1, 4, 7, 9].
В изученной нами литературе практически отсутствуют систематизированные сведения о значении таких иммуногистохимических маркеров, как эпидермальный фактор роста HER 2 neu, тканевые маркеры пролиферации и апоптоза в построении оптимальной модели для оценки риска метастазирования рака молочной железы в легкие у отдельного больного и выбора метода лечения.
Установление закономерностей экспрессии маркеров опухолевого роста HER 2 neu, Ki 67, P 53 при метастазировании рака молочной железы в легкие.
Проведена сравнительная оценка показателей иммуногистохимического статуса у больных раком молочной железы с метастазами в легкие, находившихся на лечении в клинике факультетской хирургии и онкологии ГОУ ВПО Саратовского ГМУ им. В. И. Разумовского Минздравсоцразвития России, НУЗ Дорожная клиническая больница на ст. Саратов II ОАО «РЖД» за период с 2008 по 2010 гг.
В группы наблюдения были включены 62 больных раком молочной железы с метастазами в легкие (средний возраст составил 57,6 лет). Исследование проводилось в три этапа исследования: I этап — исследование уровня HER 2 neu, Ki 67, P 53 у первичных больных (до выявления метастазов в легкие); II этап — исследование уровня HER 2 neu, Ki 67, P 53 в метастатическом лимфоузле у первичных больных (до выявления метастазов в легкие); III этап — исследование уровня HER 2 neu, Ki 67, P 53 метастатического узла в легких у больных раком молочной железы.
Определение HER 2 neu, Ki 67, P 53 проводилось авидин-биотиновым методом. Методика приготовления срезов из парафинового блока для иммуногистохимии практически не отличается от обычного их изготовления для гистологической окраски. Результаты иммуногистохимической реакции могут оцениваться полуколичественным способом. Следует отметить, что универсальной оценки иммуноокрашивания нет, в исследовании применялась качественная оценка реакции и выражалась как отрицательная (-), слабо положительная (+), умеренно положительная (++) и сильно положительная (+++) реакции.
Статистический анализ и графика выполнялись с помощью стандартного пакета прикладных программ «Statistica 6.0», «Excel 2000». При статистической обработке полученных результатов использовались: критерий Шапиро-Вилкс для оценки нормальности распределения, критерий Стьюдента для независимых переменных, критерий Манна-Уитни для оценки значимости различий между группами при отсутствии нормальности распределения признака, односторонний критерий Фишера для оценки значимости различий между группами по качественным признакам.
Результаты исследования и их обсуждение
Результаты исследований показали, что частота встречаемости опухолей с гиперэкспрессией HER 2 neu на I этапе исследования составила 58 %, тогда как опухоли с отрицательным HER 2 neu статусом отмечались в 14,5 % наблюдениях. Экспрессия HER 2 neu как фактор прогноза статистически коррелирует с экспрессией рецепторов эстрогенов (РЭ), рецепторов прогестерона (РП). При оценке гормонального статуса иммуногистохимическим методом положительная экспрессия рецепторов эстрогенов выявлена в 35 % наблюдениях, из них слабая отмечена в 57,2 % наблюдениях, умеренная в 28,6 % наблюдениях и выраженная — в 14,3 % наблюдениях. Экспрессия рецепторов прогестерона отмечена в 45 % наблюдениях, из них выраженная экспрессия выявлена в 22,2 % наблюдениях, умеренная — в 22,2 % наблюдений, слабая в 55,6 % наблюдений. Увеличение экспрессии HER 2 neu сопровождается уменьшением экспрессии РЭ в 75 % наблюдений и уменьшением экспрессии РП в 80 % наблюдений (p Заключение
Анализ приведенных выше данных относительно закономерностей экспрессии маркеров опухолевого роста HER 2 neu, Ki 67, P 53 при метастазировании рака молочной железы в легкие позволил сделать следующие выводы:
Что значит опухолевые клетки не экспрессируют
ИГХ, иммуногистохимическое исследование ткани, исследование образца опухолевой ткани, исследование ткани опухоли.
Какой биоматериал можно использовать для исследования?
Локализация б/м: образец ткани (биоптат) опухолевого образования стенки матки.
Общая информация об исследовании
Миома матки является самым распространенным доброкачественным новообразованием органов женской репродуктивной системы и выявляется у 25-30 % женщин.
Самая высокая заболеваемость и большинство показаний к оперативному лечению (быстрый рост, большие размеры узла, подозрение на малигнизацию лейомиомы) приходятся на перименопаузальный возрастной период, являющийся наиболее критическим по подобным рискам в жизни женщины. Возникающие болезни адаптации и компенсации, эндокринные, метаболические и иммунологические расстройства предрасполагают к манифестации опухолевых заболеваний.
Существуют определенные трудности в тактике ведения данного контингента больных. Реальный прогресс в решении проблем морфологической диагностики опухолей достигнут с использованием иммуноцистохимических методик. Оценка пролиферативной активности опухоли стала возможной на основании анализа белков ядра, связанных с репликацией ДНК, выявленных при помощи антител к Ki-67. Полученные данные помогают определиться с методикой лечения и объемом оперативного вмешательства по поводу быстро растущей миомы. Прежде всего это касается решения вопроса о сохранении придатков матки.
Большое значение при выборе тактики лечения, прогнозе риска осложнений имеет установление гистологического типа лейомиомы матки. ВОЗ рекомендует выделять обычную, или простую, лейомиому и гистологические варианты лейомиомы (клеточная, митотически активная, эпителиоидная, миксоидная, атипическая лейомиома и липолейомиома и т. д.). В настоящее время описано три основные формы миомы матки: 1) простая лейомиома, развивающаяся по типу доброкачественной очаговой мышечной гиперплазии, 2) митозы отсутствуют вовсе либо 3) единичные. Данная методика позволяет помочь в диагностике и дифференцировании лейомиом.
Иммуногистохимия (ИГХ) – метод выявления точной локализации клеточного или тканевого компонента (антигена) с помощью иммунологических и гистохимических реакций; при этом иммунологический анализ срезов тканей или цитологического материала проводится в условиях сохранения морфологии клеток. В диагностической практике можно выделить несколько основных областей применения ИГХ: во-первых, при исследовании опухолей человека в целях определения гистогенеза недифференцированных опухолевых образований, отдаленных метастазов, для дифференцировки различных тканевых компонентов, составляющих комплексные опухоли; во-вторых, в целях прогностической оценки дальнейшего течения заболевания и, наконец, при назначении терапии.
В целях прогностической оценки заболевания, предсказания биологического поведения опухоли, появления метастазов, эффективности терапии проводят исследование пролиферативной активности (Ki-67), выраженности ангиогенеза, выявление рецепторов к стероидным гормонам, изучение степени анаплазии клеток (мутантный белок гена p53).
Антиген Ki-67 является специфичным и оптимальным для широкого использования в патологоанатомической практике маркером пролиферации. Он впервые описан Gerdes и соавторами в 1983 г., состоит из двух полипептидных цепей с молекулярной массой 345 и 395 кДа. Это основная часть нуклеарного матрикса, в течение интерфазы ассоциированная с хромосомами фазы митоза. Ki-67−димерная молекула, имеющая тесную связь с 10-й хромосомой, конкретная роль этого протеина в процессе клеточного деления до сих пор точно не выяснена. Экспрессия Кi-67 позволяет выделить опухолевые клетки, находящиеся в активной фазе клеточного цикла, на всём его протяжении (G1-, S-, G2- и M-фазы). Кi-67 отсутствует только в G0-периоде. Активно пролиферирующие опухолевые клетки представляют собой «фракцию роста» новообразования. Антиген Ki-67, выявляемый соответствующими моноклональными антителами, представляет собой короткоживущий протеин, он разрушается в течение 1,5-2 часов. Поэтому антитела к Ki-67 выявляют только делящиеся клетки, так как Ki-67 не успевает накапливаться и не остается в покоящихся клетках. Пролиферативная активность является ведущим фактором как в механизме злокачественной трансформации клеток, так и в биологическом поведении уже возникших опухолей. Это наиболее важная характеристика фенотипа опухоли, в значительной степени определяющая скорость роста новообразования, риск метастазирования, потенциальный ответ на лечебные мероприятия и исход онкологического заболевания. Многие факторы, влияющие на течение и исход онкологических заболеваний, свое патогенетическое действие на опухоль опосредуют через изменение пролиферативной активности. Оценка пролиферативной активности опухолевых клеток необходимо не только для определения биологических характеристик опухолей, но и для селективного подхода к выбору терапии.
Индекс пролиферативной активности в различных опухолях имеет разные значения, являясь при этом независимым прогностическим признаком, определяющим клиническое течение и прогноз заболевания. При Ki-67 менее 15 % опухоль считается менее агрессивной, при показателе более 30 % опухоль считается высокоагрессивной. При высоком уровне (выраженном в %) Ki-67 опухоль с более высокой вероятностью ответит на химиотерапевтическое лечение. При низком его уровне опухоль при определённых условиях лучше отреагирует на гормонотерапию. Тест проводится на образце ткани, полученном из опухоли в результате биопсии или оперативным путем.
Дополнительно проводится комплексное определением пролиферативной активности гладкомышечных актинов – сократительных белков, являющихся главными компонентами системы микрофиламентов клетки. Выявлено шесть основных изоформ актина. Антитела к альфа-актину гладких мышц являются надежными маркерами для определения гладкомышечных опухолей. SMA и α-SMA также окрашивают клетки с частичной гладкомышечной дифференцировкой: перициты, миоэпителиальные клетки и миофибробласты. Определение перицитов вокруг сосудистых структур – признак доброкачественного сосудистого процесса, тогда как в большинстве злокачественных сосудистых новообразованиях число перицитарных клеток снижено. Высокая экспрессия гладкомышечного актина отмечается при непролиферативной и умеренной степени пролиферативной формы лейомиомы. В случае пролиферативной формы изменений выраженной степени экспрессия гладкомышечного актина слабее. Маркером, определяющим благоприятное течение заболевания, является высокая экспрессия гладкомышечного актина.
Комплексное гистологическое и иммуногистохимическое исследование с определением пролиферативной активности в растущих лейомиомах по экспрессии KI-67 и гладкомышечного актина представляет ценный современный метод диагностики, позволяющий определить степень пролиферативной активности и анаплазии опухолевых клеток, охарактеризовать прогноз и предложить адекватные методы лечения. Однако не следует и преувеличивать возможности данного метода при лечении конкретного пациента. Данный вид обследования является только дополнительной методикой исследования, и его результаты должны быть интерпретированы в контексте с другими данными обследования, включая клинические.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
При использовании данного метода визуализации антигенов должно получиться интенсивное четко выявляемое окрашивание тканевых антигенов в исследуемом образце и позитивном контроле. Окрашивание негативного контроля также необходимо принимать во внимание при оценке специфичного расположения исследуемых антигенов. Интерпретация полученных результатов ИГХ-реакции включает такие термины, как «выраженная позитивная реакция», «ложно-позитивная реакция», «негативная реакция», «ложно-негативное окрашивание».
Кто назначает исследование?
Что значит опухолевые клетки не экспрессируют
Вне зависимости от того, что заболеваемость раком желудка в России не находится на высоком уровне, в структуре смертности от злокачественных новообразований он занимает 2 место. Это свидетельствует о поздней диагностике рака желудка и агрессивном течении заболевания [1]. Процессы прогрессирования заболевания, вероятность метастазирования и развитие устойчивости к применяемой терапии определяются особенностями экспрессии определенных генов, изменением фенотипа опухолевых клеток, что сопровождается закономерными метаболическими, морфологическими и иммунологическими их изменениями [2; 3]. Кроме того, указанные свойства опухолей определяются наличием особой субпопуляции клеток – опухолевыми, раковыми стволовыми клетками (ОСК, РСК). Показано, что маркеры, выявленные на раковых стволовых клетках, представлены и на определенных типах соматических клеток организма человека, на эмбриональных и мезенхимальных стволовых клетках [4]. Несмотря на то что данные клетки достаточно трудно идентифицировать, число работ, посвященных изучению биологических и клинических особенностей ОСК при различных формах онкологических заболеваний, неуклонно растет [5].
В разных опухолях ОСК экспрессируют различные маркеры и их комбинации, которые выявляются также на нормальных стволовых клетках или клетках-предшественницах, элементах стромы опухоли или опухолевых клетках, не имеющих свойств стволовых, поэтому, возможно, только часть клеток, выбранных по их экспрессии, является ОСК. К настоящему моменту окончательно не решен вопрос о стабильности фенотипа ОСК в процессе прогрессии опухоли или при переходе из систем in vivo к in vitro. Кроме того, разные подтипы опухолей одного органа могут иметь ОСК, экспрессирующие разные маркеры [6].
CD44 изолированно или в комбинации с другими маркерами выявляется на ОСК в раке молочной, предстательной и поджелудочной желез, печени, колоректальном раке, опухолях головы и шеи, желудка [8].
CD133 (АС133, проминин-1) впервые был обнаружен Х. Yin и соавт. в 1997 г. на гемопоэтических стволовых клетках [9]. Это гликопротеин с пятью трансмембранными доменами молекулярной массой 120 кД, взаимодействующий с холестеролом [10], принадлежит к семейству промининов, имеет 3 изоформы: CD133-1, CD133-2, CD133-3. Ген (PROM1) картирован на 4р15.32. Ассоциирован с мембранными выпячиваниями, но функция его точно не известна. Было также показано, что экспрессия антигена CD133 коррелирует с выживаемостью пациентов с аденокарциномой желудка [11]. Кроме того, у пациентов с колоректальной карциномой комбинация CD133, CD44 и CD166 может успешно идентифицировать пациентов при рецидиве и метастазировании с низким, средним и высоким риском [12].
Для идентификации ОСК при раке желудка чаще всего используют фенотипический маркёр CD44+, наличие которого с высокой вероятностью может указывать на данный тип клеток. Использование же CD133 при обнаружении РСК при раке желудка отмечается не так часто, и его информативность при данной форме опухолей обсуждается.
Таким образом, к настоящему времени накоплен определенный опыт исследования ОСК при различных солидных опухолях, однако вопросы, связанные с особенностями фенотипической организации и «поведении» данной популяции клеток при ряде заболеваний, в частности при различных формах рака желудка, остаются изучены не полностью.
Материалы и методы
В исследование включено 18 больных раком желудка в возрасте от 30 до 80 лет. Больные давали письменное информированное согласие на проведение исследований, подвергались стандартному в данном случае объему обследований. Пациенты были разделены на две группы:
1 группа – М0, рак желудка без метастазов, 11 человек, степень дифференцировки опухоли – G2, средний возраст 58,9±9,7.
2 группа – М1, рак желудка с выявленными метастазами в брюшину и большой сальник, 7 человек, степень дифференцировки опухоли– G2, средний возраст 53,4±11,9.
Непосредственно после оперативного вмешательства осуществляли забор следующих образцов: опухоль (ОП), перифокальная зона (ПЗ), сальник (СА), брюшина (БР), которые ex temporae помещались в раствор CellWash и подвергались дезинтеграции с использованием BD Medimachine в течение 30–60 сек. Полученную клеточную взвесь после фильтрования центрифугировали в течение 4 мин. при 1500 об/мин. в центрифуге Еppendorf 5702 R. Осажденные клетки ресуспендировали раствором CellWash.
Статистическая обработка полученных результатов предполагала расчет средних значений и стандартных отклонений. После проверки характера распределения проводили оценку статистической значимости различий между группами. В случае нормального распределения использовали параметрический критерий Стьюдента, в противном случае – непараметрический критерий Манна-Уитни. Различия считали статистически значимыми при р≤0,05.
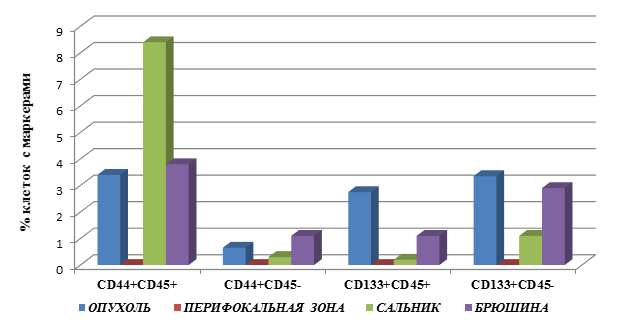
Выявлены следующие особенности процентного содержания клеток с маркёрами опухолевых стволовых клеток в группе пациентов с раком желудка без метастатических поражений (М0), представленные на рисунке 1.
Определение клеток с фенотипом CD45-CD44+ позволило выявить следующие закономерности. Наибольшее количество клеток данного фенотипа выявлено в ткани БР – 1,1±0,5, что выше значений данного показателя в ОП (0,65±0,3) и СА (0,3±0,1) на 69% (в 1,7 раза) и 267% (3,7 раза) соответственно, р=0,001.
Другим маркёром опухолевых стволовых клеток является CD133+. Определение клеток, имеющих фенотип CD45+CD133+, выявило большее процентное число данных клеток в ткани ОП – 2,75±0,9. В БР и СА количество данных клеток было ниже значений в ОП соответственно на 60% (2,5 раза) – 1,1±0,4, и 93% (13,8 раз) – 0,2±0,05, р=0,02. В ПЗ клетки с данным фенотипом не определялись (рис. 1).
Рис. 1. Процентное содержание клеток с маркерами ОСК в тканях больных раком желудка, группа 1 (М0) – без метастатических поражений
Следует отметить, что определение процентного содержания клеток с фенотипом CD45-CD133+ имело аналогичные закономерности распределения, однако число данных клеток во всех тканях было выше, чем клеток с фенотипом CD45+CD133+. Максимальное число данных клеток выявлено в ОП – 3,35±2,7, затем в БР – 2,9±1,1 и в СА – 1,1±0,4. Полученные результаты меньше значений в ОП соответственно на 13% (в 1,2 раза) для БР и на 67% (в 3 раза) для СА, р=0,02. В ПЗ клеток с данным фенотипом не выявлено.
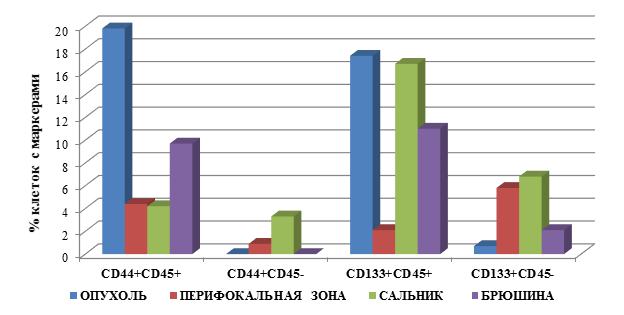
Выявлены следующие особенности процентного содержания клеток с маркёрами опухолевых стволовых клеток в группе пациентов с раком желудка, стадия дифференцировки опухоли G2 с метастатическими поражениями (М1), которые представлены на рисунке 2.
Наибольшее процентное содержание клеток с фенотипом CD45+CD44+ у больных раком желудка с метастатическими поражениями выявлено в ткани ОП – 19,8±4,5, в то время как в БР – 9,7±1,5, с практически одинаковым количеством данных клеток в ПЗ, СА – соответственно 4,4±1,5 и 4,2±1,2. Полученные значения ниже данного показателя в ОП на 79% (в 4,7 раза), 78% (4,5 раза) и 51% (в 2 раза) для СА, ПЗ и БР соответственно (для всех результатов р=0,03).
Обращает внимание тот факт, что у больных с метастатическими поражениями при РЖ по сравнению с данным показателем у пациентов без метастазов количество клеток с фенотипом CD45+CD44+ в ОП было выше на 482% (в 5,8 раза), в БР – на 155% (в 2,6 раза), а в СА – ниже на 50% (в 2 раза), р=0,03. Кроме того, данный тип клеток появляется в ПЗ пациентов группы М1, в то время как у больных М0 они не определялись (рис. 2).
Наибольшее количество клеток с фенотипом CD45-CD44+ у больных с метастазами отмечается в СА и ПЗ, соответственно 3,3±1,4 и 0,9±0,05, что превышает в 11 раз показатель у пациентов без метастазов (для СА). В ОП и БР данный тип клеток не выявлен при наличии метастазов, в то время как без них они определялись.
Рис. 2. Процентное содержание клеток с маркерами ОСК в тканях больных раком желудка, группа 2 (М1) – с метастатическими поражениями
При определении другого, менее часто используемого для идентификации ОСК РЖ маркера CD133, выявлены следующие особенности при наличии метастатических поражений.
Количество клеток с фенотипом CD45+CD133+ было максимальным в ОП и СА, соответственно 17,4±2,5 и 16,7±2,1, что выше значений у пациентов группы М0 в 6,3 и в 84 раза, т.е. максимальный прирост данных клеток выявлен в СА. В ПЗ у больных М1 группы количество было ниже на 37% (в 1,6 раза) по сравнению с значениями в ОП, но превышало значения данного показателя у пациентов без метастатических поражений в 10 раз. Следует отметить, что на фоне метастатических поражений данные клетки обнаруживаются и в ПЗ, чего не наблюдалось у больных РЖ без метастазов. Однако значение данного показателя было ниже на 88% (в 8,3 раза) количества данных клеток в ОП.
У больных группы М1 клетки фенотипом CD45-CD133+ в максимальном количестве определялись в СА, ПЗ и БР, соответственно 6,8±1,5, 5,8±1,8 и 2,1±0,3, в то время как в ОП их число было относительно невелико – 0,7±0,05. При этом, как правило, количество данных клеток существенно превышало данный показатель у больных без метастатических поражений в случае СА – в 6 раз (выше на 518%), в ПЗ эти клетки обнаруживались у пациентов с поражениями, в то время как без метастазов они не выявлялись. Однако количество клеток с фенотипом CD45-CD133+ снижалось у пациентов с метастазами в ОП и БР – отмечено снижение данного показателя на 79% (4,8 раза) и 28% (1,4 раза) соответственно, р=0,02.
Таким образом, у больных РЖ с метастатическими поражениями по сравнению с пациентами без метастазов (рис. 2):
Проведенное исследование позволило выявить некоторые особенности распределения клеток, имеющих маркёры ОСК в различных тканях у больных раком желудка, что может в дальнейшем быть использовано при оценке особенностей развития и прогрессирования заболевания, эффективности проводимой терапии. Полученные результаты являются основой для дальнейшего научного поиска в отношении наиболее полной характеристики гетерогенной опухолевой популяции при раке желудка, роли отдельных клеток в росте, прогрессии и метастазировании опухоли.