Что значит оказывает бронхолитическое и секретолитическое действие
Что значит оказывает бронхолитическое и секретолитическое действие
ГБОУ ВПО «Первый МГМУ им. И.М. Сеченова» Минздрава России, Москва
Кмукоактивным препаратам относят лекарственные средства, позволяющие управлять кашлем путем изменения количества и свойств бронхиального секрета (БС) [1]. Среди них выделяют 3 основные группы: мукокинетики – препараты, влияющие на реологические свойства (объем, вязкость, подвижность) золевого компонента БС (усиливают мукоцилиарный транспорт); муколитики – препараты, которые влияют на реологические свойства (вязкость, эластичность, адгезивность) преимущественно гелевого слоя БС (разрушают полимерные связи); мукорегуляторы – лекарственные средства, изменяющие продукцию БС и соотношение основных типов клеток в слизистой оболочке бронхов [1–3]. Кроме того, к мукоактивным средствам относятся препараты, восстанавливающие или поддерживающие функциональную активность цилиарных клеток слизистой оболочки бронхов, – стимуляторы мукоцилиарного клиренса (МЦК; бронхолитики).
Мукокинетики, как правило, являются препаратами растительного происхождения и в рамках серьезных клинических исследований не изучались. Стоит также отметить, что мукокинетики рефлекторного действия (корни солодки, алтея, трава термопсиса) в дозах, достаточных для значимого усиления секреции, способны вызывать ряд нежелательных явлений – тошноту, рвоту, бронхоспазм. Поэтому в настоящее время мукокинетики в значительной мере вытеснены более эффективными и безопасными муколитическими препаратами [1].
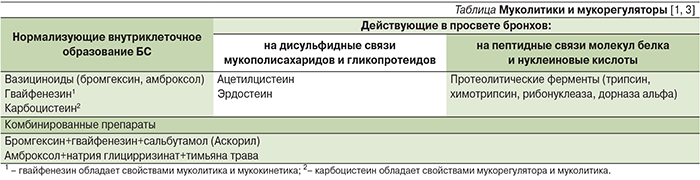
Среди муколитиков и мукорегуляторов принято выделять две группы: лекарственные средства, реализующие свой эффект преимущественно в просвете бронхов, и препараты, нормализующие образование БС (см. таблицу).
Основными целями проводимой муколитической терапии являются уменьшение образования мокроты, ее регидратация, разжижение и стимуляция выведения. Действие ферментных препаратов основано на расщеплении комплекса мукопротеинов или нуклеиновых кислот, что способствует уменьшению вязкости мокроты. Применение ферментных препаратов может сопровождаться аллергическими реакциями, усугублением бронхиальной обструкции; исключение составляет дорназа альфа, использующаяся для разрушения внеклеточной ДНК, содержащейся в вязком БС больных муковисцидозом. Применение данной категорией больных дорназы альфа позволяет снижать риск развития инфекционных осложнений. Препарат также используется пациентами с бронхоэктазами.
Группу препаратов, нормализующих внутриклеточное образование БС, составляют бромгексин, амброксол и мукорегулятор карбоцистеин. Бромгексин является пролекарством и в организме метаболизируется с образованием активного метаболита амброксола, который и определяет основные эффекты препарата. Бромгексин и амброксол оказывают муколитическое и секретолитическое действия. Отличительной особенностью бромгексина является наличие у него умеренного противокашлевого эффекта. Амброксола гидрохлорид, обеспечивает более выраженный муколитический эффект. Препарат стимулирует образование трахеобронхиального секрета пониженной вязкости за счет изменения химизма мукополисахаридов мокроты и улучшает мукоцилиарный транспорт путем стимуляции двигательной активности ресничек мерцательного эпителия. Способность амброксола повышать синтез, секрецию сурфактанта и блокировать его распад значительно выше, чем у бромгексина. Препарат может применяться парентерально, перорально или ингаляционно.
Карбоцистеин одновременно обладает мукорегулирующим и муколитическим эффектами. Механизм действия препарата связан с активацией сиаловой трансферазы бокаловидных клеток слизистой оболочки бронхов и нормализацией соотношения кислых и нейтральных сиаломуцинов БС (восстановление вязкости и эластичности слизи) [1]. Мукорегуляторное действие заключается в уменьшении в слизистой оболочке бронхов избыточного количества бокаловидных клеток и снижении количества вырабатываемой слизи. Применение карбоцистеина сопровождается восстановлением секреции IgА, улучшением МЦК за счет восстановления активности реснитчатых клеток и реализуется на всем протяжении респираторного тракта (полость носа, придаточные пазухи носа, верхние и нижние дыхательные пути). Препарат выпускается только в формах для перорального применения (таблетки, капсулы, сироп).
Эрдоцистеин – муколитический препарат смешанного действия, содержащий две сульфгидрильные группы, которые высвобождаются в процессе метаболизма. В результате образуется три активных метаболита, которые обладают муколитическими и антиоксидантными свойствами. Влияние эрдоцистеина на МЦК обусловлено снижением вязкости мокроты (разрыв дисульфидных мостиков), усилением секреторной функции эпителия дыхательных путей и стимуляцией моторной функции, также препарат обладает умеренным противокашлевым эффектом. Благодаря сульфгидрильным группам эрдоцистеин оказывает антиоксидантное действие за счет снижения образования активных форм кислорода. Эрдоцистеин увеличивает концентрацию IgA в слизистой оболочке дыхательных путей. Перспективы применения препарата связаны с возможностью его длительного использования пациентами с хронической обструктивной болезнью легких (ХОБЛ).
В ряде исследований было показано, что применение эрдоцистеина сопровождалось уменьшением частоты обострений ХОБЛ, стабилизацией вентиляционных показателей и улучшением качества жизни больных.
Муколитическое действие ацетилцистеина (N-ацетил-L-цистеин) реализуется в просвете бронхов и основывается на наличии в его молекуле сульфгидрильных групп, которые разрывают дисульфидные связи мукополисахаридов мокроты, делая ее менее вязкой. Ацетилцистеин является мощным антиоксидантом, оказывающим как прямое, так и опосредованное действие. Препарат инактивирует активные метаболиты кислорода за счет наличия свободной тиольной группы, взаимодействующей с группами свободных радикалов и реактивных кислородных метаболитов (прямое антиоксидантное действие). Непрямой антиоксидантный эффект ацетилцистеина связан с увеличением синтеза глутатиона. Сочетание муколитических и антиоксидантных свойств позволяет успешно использовать ацетилцистеин в терапии ХОБЛ. Препарат доступен в разнообразных лекарственных формах как для перорального, так и для парентерального, а также ингаляционного применения.
Среди стимуляторов МЦК наибольшее признание нашли селективные β2-адреномиметики (сальбутамол, фенотерол). Применение метилксантинов в настоящее время ограничено в связи с их непредсказуемой фармакокинетикой и узким терапевтическим интервалом.
Сальбутамол, являющийся селективным агонистом β2-адренорецепторов, способен увеличивать МЦК, усиливать секреторную деятельность слизистых желез и продукцию сурфактанта. Он оказывает дозозависимое бронхолитическое действие (при наличии бронхообструкции), снижает продукцию и высвобождение гистамина, медленно реагирующей субстанции анафилаксии из тучных клеток, факторов хемотаксиса из нейтрофилов.
Помимо этого препарат стимулирует митотическую активность и восстановление реснитчатого эпителия дыхательных путей, а также модулирует холинергическую нейротрансмиссию. Все эти свойства позволяют использовать сальбутамол как модулятор МЦК и бронхолитический агент. В определенных клинических ситуациях (например, у пациентов с острым бронхитом, обострением ХОБЛ) терапия β2-адреноагонистами в сочетании с муколитическими препаратами является наиболее целесообразной.
В тех случаях, когда у больных одновременно имеется несколько симптомов поражения трахеобронхиального дерева (например, кашель, наличие вязкой, трудноотделяемой мокроты, бронхообструкция), целесообразно использовать комбинированные мукоактивные препараты. Они должны отвечать следующим требованиям:
1) содержать не более 3 активных ингредиентов из различных фармакологических групп (более одного активного ингредиента из каждой фармакологической группы: оптимально мукокинетик, муколитик и регулятор МЦК); 2) каждый активный ингредиент должен присутствовать в эффективной и безопасной дозировке, позволяющей получать аддитивный, суммационный или потенцирующий эффект; 3) препарат должен терапевтически соответствовать типу и тяжести симптомов, которые необходимо излечить; 4) не должно происходить увеличения риска развития побочных явлений.
Примером эффективной мукоактивной комбинации является препарат Аскорил, содержащий в своем составе муколитик (бромгексин), муколитик/мукокинетик (гвайфенезин) и β2-адреномиметик (сальбутамол). Все компоненты Аскорила обладают синергичным действием, улучшая МЦК, регулируя секрецию мокроты и ее реологические свойства, снижая избыточный тонус бронхов. В результате происходит быстрое очищение бронхов от измененного трахеобронхиального секрета и уменьшение/исчезновение кашля. Аскорил одновременно воздействует практически на все звенья патогенеза острых и хронических бронхолегочных заболеваний, сопровождающихся образованием трудноотделяемого вязкого секрета (бронхиальная астма, трахеобронхит, пневмония, эмфизема легких, коклюш, ОРВИ и др.).
Использование в фиксированной комбинации фармакологических соединений, одновременно влияющих на МЦК, тонус гладких мышц бронхов, количественные и качественные показатели гель- и золь-слоев БС, позволяют значительно уменьшить разовые дозы компонентов Аскорила, что позволяет значительно повысить безопасность и эффективность комбинированной фармакотерапии по сравнению с применением монопрепаратов.
Препарат характеризуется высокой безопасностью, а его эффективность изучена в ряде клинических исследований у взрослых и детей [4–7]. Применение Аскорила позволяет снизить длительность лечения заболевания, уменьшить количество применяемых лекарственных средств и риск побочных эффектов, повысить приверженность больного лечению.
К нефармакологическим методам воздействия на МЦК относят аппаратные методы высокочастотной перкуссионной вентиляции легких (ВПВЛ), кинезитерапию. ВПВЛ основана на подаче пациенту малых объемов воздуха («перкуссии») с высокой регулируемой частотой (60–400 циклов в минуту) и управляемым уровнем давления через специальный открытый дыхательный контур. «Перкуссии» могут подаваться через маску, загубник, интубационную трубку и трахеостому. Другим вариантом ВПВЛ является методика высокочастотных колебаний (осцилляции), которые через грудную клетку передаются на дыхательные пути и проходящий по ним поток газа. Высокочастотные колебания создаются с помощью надувного жилета, который плотно облегает грудную клетку и соединен с воздушным компрессором.
Кинезитерапия включает различные методы дыхательной гимнастики, общую лечебную физкультуру, проведение ингаляционной терапии. Наиболее простыми и эффективными методами кинезитерапии являются дренажные положения тела, упражнение «сантиметр», дыхательная гимнастика, в т. ч. с сопротивлением выдоху, флаттер-терапия, клопфмассаж, хаффинг.
Для успешного лечения продуктивного кашля необходимо понимание цели терапии и знание показаний к применению мукоактивного средства и его фармакологических особенностей. Например, наиболее частой клинической ситуацией является обращение за медицинской помощью больного с острым кашлем, связанным, как правило, с течением острой респираторной вирусной инфекции (простуда, острый фарингит). В данной ситуации целесообразны назначение смягчающих, увлажняющих средств, обильное питье теплых растворов, щелочные ингаляции. Назначения мукоактивных препаратов чаще всего не требуется. Применение муколитиков может быть зарезервировано у больного ОРВИ с жалобами на продуктивный кашель (нередко такая ситуация наблюдается у курильщиков). Назначение супрессантов кашля центрального или периферического действия может быть оправданно только при сильном надсадном кашле, нарушающем сон и дневную активность пациента. Одновременный прием противокашлевых и мукоактивных препаратов не рекомендуется.
Напротив, пациенты с острым бронхитом, симптомами которого являются продуктивный кашель, одышка, свистящее дыхание, повышение температуры тела, общее недомогание и сухие хрипы, выслушиваемые при аускультации легких, требуют назначения мукоактивной терапии (бромгексин, амброксол, ацетилцистеин, сироп плюща). В случае нередкого сочетания продуктивного кашля с бронхообструктивным синдромом применяются комбинированные препараты, обладающие как муколитическим и мукокинетическим, так и бронходилатирующим эффектами (Аскорил). Применение бронхолитиков (сальбутамол, фенотерол, ипраторопия бромид) оправданно для пациентов с клинически выраженной бронхообструкцией, неотвязным кашлем и признаками бронхиальной гиперреактивности.
Важным компонентом терапии является применение мукоактивных средств больными пневмонией. Адекватное дренирование очага инфекции способствует более быстрому разрешению заболевания. В данной ситуации возможно сочетание различных препаратов – муколитиков и мукокинетиков, т.к. такой подход расширяет возможности эффективного влияния на МЦК. Для пациентов с тяжелыми формами заболевания целесообразен парентеральный или небулайзерный путь введения препаратов.
При стабильном течении ХОБЛ для пациентов с постоянным продуктивным кашлем и частыми обострениями целесообразен длительный прием мукоактивных препаратов (ацетилцистеин, карбоцистеин, эрдоцистеин). Так, в многоцентровом исследовании Pantheon [8], включившем 1006 пациентов, частота обострений ХОБЛ на фоне применения ацетилцистеина снизилась в среднем на 22%, при этом лучшие результаты наблюдались у больных со среднетяжелым течением ХОБЛ (частота обострений снизилась на 39%) и пациентов, не получавших ингаляционные стероиды (снижение частоты обострений на 29%). Больным, переносящим обострение ХОБЛ, одним из клинических симптомов которого является продуктивный кашель, показано применение муколитических препаратов (Аскорил, ацетилцистеин, карбоцистеин, эрдостеин). По мнению ряда российских авторов, использование комбинированных препаратов (Аскорил) способствует более быстрому регрессу симптомов обострения.
Для пациентов с бронхоэктазами, муковисцидозом, выделяющими большой объем мокроты, целесообразно длительное назначение мукорегуляторов (карбоцистеин), уменьшающих избыточное образование секрета.
Больным бронхиальной астмой назначение мукоактивной терапии, как правило, не требуется. Продуктивный кашель регрессирует при усилении базисной противоастматической терапии. В случае же присоединения бактериальной инфекции целесообразно подключение муколитической терапии. Использование препаратов для небулайзерного применения (ацетилцистеин, амброксол) не рекомендуется из-за опасности провоцирования бронхоспазма.
Принципиальным моментом рациональной мукоактивной терапии является комбинирование фармакологических методов с немедикаментозными средствами. Дыхательная гимнастика с сопротивлением выдоху, методы кинезитерапии являются эффективным дополнением к стандартному лечению. Интересны с практической точки зрения новые методы воздействия на МЦК. Так, при обострении хронической бронхолегочной патологии, протекающей с продуктивным кашлем, существенного улучшения состояния можно достичь, используя методы улучшения дренажа дыхательных путей – ВПВЛ.
Литература
Об авторах / Для корреспонденции
А.А. Зайцев – д.м.н., ГБОУ ВПО «Первый МГМУ им. И.М. Сеченова» Минздрава России, Москва; тел. 8 (499) 263-10-47
С.В. Оковитый – ГБОУ ВПО «Первый МГМУ им. И.М. Сеченова» Минздрава России, Москва
Е.В. Крюков – ГБОУ ВПО «Первый МГМУ им. И.М. Сеченова» Минздрава России, Москва
Бронхолитические препараты в терапии болезней органов дыхания
В структуре болезней органов дыхания хроническая обструктивная болезнь легких (ХОБЛ) и бронхиальная астма (БА) являются ведущими причинами заболеваемости и смертности. Патофизиологическую основу обеих нозологических форм составляет бронхиальная обструк
В структуре болезней органов дыхания хроническая обструктивная болезнь легких (ХОБЛ) и бронхиальная астма (БА) являются ведущими причинами заболеваемости и смертности.
Патофизиологическую основу обеих нозологических форм составляет бронхиальная обструкция, для купирования или коррекции которой требуется назначение бронхолитической терапии. Это положение закреплено в международных и национальных руководствах по диагностике и лечению БА и ХОБЛ [1–6].
Необходимо отметить, что БА и ХОБЛ представляют собой два самостоятельных заболевания, которые имеют различные этиологию, патогенез, прогноз, а также требуют разных подходов к лечению. Так, в частности, вентиляционные нарушения при БА характеризуются обратимой бронхиальной обструкцией и бронхиальной гиперреактивностью, что обусловливает целесообразность применения бронхолитиков, использующихся при этом заболевании. Напротив, бронхиальная обструкция при ХОБЛ неуклонно прогрессирует и обратима лишь частично. Последнее обстоятельство аргументирует целесообразность клинического применения бронхолитиков и при этом заболевании.
Естественно, что указанные различия между БА и ХОБЛ требуют дифференцированного подхода как к выбору конкретных бронхолитиков, так и к тактике их назначения. Так, если больным ХОБЛ бронхолитики назначаются преимущественно на постоянной основе, то пациентам с БА — чаще «по требованию» и/или в сочетании с базисной противовоспалительной терапией (глюкокортикостероидами или кромонами).
Современные бронхолитические препараты можно разделить на три группы, перечисленные ниже в том порядке, в котором они внедрялись в клиническую практику.
Антихолинергические препараты. На протяжении многих тысячелетий при необходимости лечения болезней органов дыхания применялись средства народной медицины. Упоминания об использовании растений семейства пасленовых были найдены еще в древнеегипетских папирусах. Гиппократ рекомендовал людям с болезнями легких применение курений и дымов порошков, приготовленных из высушенных корней и листьев белладонны (Atropa belladonna), дурмана (Datura stramonium), белены (Hyoscyamus niger). Недавними исследованиями было установлено, что эффект от курения антиастматических сигарет, содержащих листья Datura stramonium, сопоставим с таковым при применении современных бронхолитических средств [7].
К началу XIX в. уже было известно антихолинергическое действие алкалоидов белладонны, несколько позже ученые установили роль парасимпатической нервной системы в развитии бронхоспазма, а с середины 19-го столетия холиноблокаторы — атропин и синтезированный вскоре платифиллин — становятся «золотым стандартом» в лечении БА. Широкое использование холинолитиков по этому показанию продолжалось до 70-х гг. XX в. Лишь с появлением мощных селективных β2-агонистов, а также метилксантинов атропин утратил свое значение в лечении больных БА. Этому в немалой степени способствовало и наличие большого количества нежелательных явлений, сопутствующих введению препарата: сухость во рту, нарушения мукоцилиарного клиренса, мидриаз и др. [8].
В 70-х гг. XX в. были выделены и классифицированы мускариновые рецепторы в дыхательных путях человека (М1-, М2-, М3-рецепторы). Установление важной роли парасимпатической нервной системы в контроле бронхиальной проходимости при БА дало толчок к дальнейшим разработкам антихолинергических лекарственных средств, что привело к созданию принципиально нового препарата — ипратропия бромида [8, 9]. Однако при проведении клинических исследований у больных БА его эффективность оказалась невелика. Напротив, препарат продемонстрировал отчетливый клинический и в ряде случаев бронхолитический эффект у больных ХОБЛ. Таким образом, удалось доказать частичную обратимость бронхиальной обструкции при ХОБЛ и впоследствии установить две ее патофизиологические составляющие — обратимую и необратимую.
Обратимый («бронхолитический») компонент бронхиальной обструкции представлен воспалительным отеком слизистой дыхательных путей, аккумуляцией клеток воспаления, слизи и плазмы в просвете бронхов, спазмом гладкой мускулатуры, которые в основном контролируются парасимпатическим отделом вегетативной нервной системы, тонус которой при ХОБЛ закономерно повышен [10].
Необратимый («эмфизематозный») компонент бронхиальной обструкции обусловлен развитием и прогрессированием эмфиземы легких и так называемой болезни мелких бронхов (снижение эластической тяги легочной ткани вследствие неравномерной преимущественно центриацинарной эмфиземы, ранний экспираторный коллапс, деформация и сужение мелких бронхов). Предполагалось, что данные структурные изменения не могут служить точкой приложения бронхолитических и/или противовоспалительных лекарственных средств. Однако в дальнейшем удалось установить, что именно эти изменения в паренхиме легких обусловливают формирование гиперинфляции легких с развитием «воздушной ловушки», приводящей к нарушению опорожнения альвеол во время выдоха (наиболее наглядно этот патофизиологический феномен можно продемонстрировать при выполнении физических нагрузок). Именно этот механизм и объясняет развитие таких кардиальных симптомов ХОБЛ, как выраженная одышка и снижение толерантности к физической нагрузке, заметно ухудшающих качество жизни данной категории пациентов [11].
Наиболее известным и широко распространенным лекарственным средством из числа ингаляционных антихолинергических препаратов в настоящее время является ипратропия бромид. Препарат хорошо переносится, эффективен и безопасен при длительном применении, не вызывает развития тахифилаксии, лишен кардиотоксического действия. При этом важно отметить, что чувствительность М-холинорецепторов с возрастом не уменьшается. Вот почему в рекомендациях по ведению больных ХОБЛ подходы к назначению этого препарата определяют следующим образом: лечить «так долго, как долго симптомы заболевания будут продолжать причинять неудобства пациенту» [2].
Продолжительность действия ипратропия бромида — 4–6 ч, в результате чего возникает необходимость повторных ингаляций (4 раза в сутки), поэтому иногда проблематично контролировать возможные ухудшения бронхиальной проходимости в ночные или предутренние часы. Подобно атропину, ипратропия бромид не является селективным холиноблокатором и одинаково быстро блокирует все три типа мускариновых рецепторов, поэтому следует бдительно наблюдать за пациентом, так как блокада М2-рецепторов иногда может приводить к парадоксальной бронхоконстрикции [9].
Представителем новой генерации антихолинергических препаратов является тиотропия бромид, зарегистрированный в России в 2003 г. Особенности химической структуры препарата объясняют своеобразие его взаимодействия с мускариновыми рецепторами, а именно уникальную кинетическую селективность, т. е. различия в скорости блокирования, соответствующих подтипов мускариновых рецепторов, а также увеличение продолжительности действия [12, 13].
В ходе проведенных исследований, в частности, было показано, что длительная бронходилатация (
24 ч), регистрируемая после однократной ингаляции тиотропия бромида, сохраняется и при длительном его приеме (на протяжении 12 мес) [14, 15]. Уже через 30 мин после первой ингаляции увеличивались показатели объема форсированного выдоха за первую секунду (ОФВ1) и форсированной жизненной емкости легких (ФЖЕЛ), в дальнейшем не снижавшиеся в течение последующих 24 ч. Наибольший бронхолитический эффект отмечался ко второй неделе лечения тиотропия бромидом.
Продолжительная терапия тиотропия бромидом (в течение 12 мес) сопровождается оптимизацией показателей бронхиальной проходимости, регрессом респираторной симптоматики, улучшением качества жизни пациентов [16]. При этом отчетливо уменьшалась выраженность одышки. Известный пульмонолог P. Jones высоко оценил возможности симптоматического контроля с помощью ингаляций тиотропия бромида, отметив его саногенетический эффект: больные, длительно принимавшие препарат, более не испытывали одышки при физической нагрузке и передвигались в темпе, характерном для их возраста [17]. Регресс одышки объясняется уменьшением гиперинфляции легких и размера «воздушной ловушки». При этом в рамках длительного лечения больных ХОБЛ удалось продемонстрировать терапевтическое превосходство тиотропия бромида над ипратропия бромидом [18].
Важное преимущество ингаляционных антихолинергических препаратов — минимальная частота и выраженность нежелательных явлений. Самое распространенное из них — сухость во рту, как правило, не приводит к прекращению приема лекарственных средств [16, 18].
Метилксантины. В течение многих десятилетий метилксантины (теофиллин и др.) применяются при лечении больных БА, хотя механизм их действия длительное время оставался неясным. В 1859 г. появилось сообщение доктора Hyde Salter о том, что чашка крепкого кофе способна купировать приступ БА. В 1888 г. был выделен теофиллин из листьев чая. Длительное время подход к использованию теофиллина был чисто эмпирическим и только после уточнения механизма его действия в конце 1930-х гг. препарат получил широкое распространение. Бронхолитический эффект теофиллина осуществляется посредством ингибирования изоформ фосфодиэстеразы с последующим увеличением внутриклеточного содержания цАМФ и релаксацией гладких мышц дыхательных путей. Кроме того, установлены иммуномодулирующий и противовоспалительный эффекты теофиллина, что позволяет назначать данное средство в рамках монотерапии при невозможности применения ингаляционных противовоспалительных и/или бронхолитических препаратов. Кратковременный прием пролонгированных теофиллинов в течение 6–12 нед сопровождается улучшением показателей симптоматического контроля над заболеванием, увеличением ОФВ1 [19, 20].
Обсуждая возможности применения теофиллина у пациентов с бронхообструктивными заболеваниями, важно учитывать и его внелегочные эффекты: улучшение периферической вентиляции, уменьшение развития «воздушных ловушек», улучшение функции диафрагмы, особенно при гиперинфляции легкого, улучшение (восстановление) мукоцилиарного клиренса, дилатацию артерий малого круга кровообращения, снижение давления в легочной артерии и гемодинамическую «разгрузку» правых отделов сердца, повышение физической работоспособности.
В то же время известно, что метаболизм теофиллина подвержен значительным изменениям. Так, у курильщиков, лиц, страдающих хроническим алкоголизмом, больных, принимающих рифампицин или противосудорожные препараты, клиренс теофиллина ускорен, а значит, при использовании стандартного режима дозирования плазменная концентрация препарата может не достигать терапевтических показателей. Напротив, с возрастом, при наличии артериальной гипоксемии (РаО2
И. Л. Клячкина, кандидат медицинских наук, доцент
ГИУВ МО РФ, Москва