Что значит незавершенный уровень в химии
Как заполняются электронные уровни, подуровни и орбитали по мере усложнения атома.



Если говорить более строго, то относительное расположение подуровней обусловлено не столько их большей или меньшей энергией, сколько требованием минимума полной энергии атома.
Распределение электронов по атомным орбиталям происходит, начиная с орбитали, имеющей наименьшую энергию (принцип минимума энергии), т.е. электрон садится на ближайшую к ядру орбиталь. Это значит, что сначала заполняются электронами те подуровни, для которых сумма значений квантовых чисел (n + l) была минимальной. Так энергия электрона на 4s-подуровне меньше энергии электрона, находящегося на 3d-подуровне. Следовательно, заполнение электронами подуровней происходит в следующем порядке: 1s
Рис.2.1.1. Энергетические диаграммы валентных подуровней атомов хрома и меди
Правила заполнения электронных оболочек:
1. Сначала выясняем, сколько всего электронов содержит атом интересующего нас элемента. Для этого достаточно знать заряд его ядра, который, всегда равен порядковому номеру элемента в Периодической таблице Д.И. Менделеева. Порядковый номер (число протонов в ядре) в точности равен и числу электронов во всем атоме.
2. Последовательно заполняем орбитали, начиная с 1s-орбитали, имеющимися электронами, учитывая принцип минимальной энергии. При этом нельзя располагать на каждой орбитали более двух электронов с противоположно направленными спинами (правило Паули).
3. Записываем электронную формулу элемента.
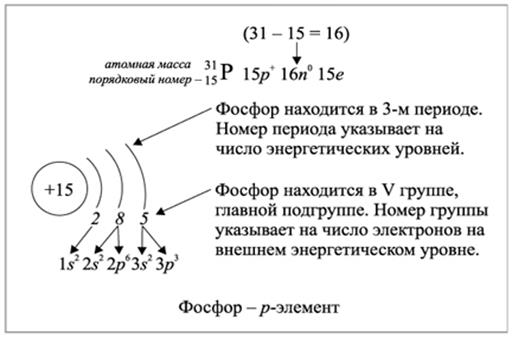
Рис.2.1.2. Заполнение энергетических уровней электронами элемента фосфора
Электронную структуру атома водорода (z = 1) можно изобразить следующим образом:
Каждый атом последующего химического элемента в периодической системе представляет собой многоэлектронный атом.
Атом лития, так же как и атом водорода и гелия, имеет электронную структуру s-элемента, т.к. последний электрон атома лития «садится» на s-подуровень:
+3Li 1s 2 2s 1 2p 0
В атоме бора появляется первый электрон в p-состоянии:
+5В 1s 2 2s 2 2p 1
Запись электронной формулы проще показать на конкретном примере. Допустим, нам надо выяснить электронную формулу элемента с порядковым номером 7. В атоме такого элемента должно быть 7 электронов. Заполним орбитали семью электронами, начиная с нижней 1s-орбитали.
Электронная формула элемента с порядковым номером 7 (это элемент азот, имеющий символ “N”) выглядит так:
+7N 1s 2 2s 2 2p 3
Внешним уровнем атома называется самый далекий от ядра уровень, на котором есть валентные электроны. Именно эта оболочка соприкасается при столкновении с внешними уровнями других атомов в химических реакциях. При взаимодействии с другими атомами азот способен принять 3 дополнительных электрона на свой внешний уровень. При этом атом азота получит завершенный, то есть максимально заполненный внешний электронный уровень, на котором расположатся 8 электронов.
Завершенный уровень энергетически выгоднее незавершенного, поэтому атом азота должен легко реагировать с любым другим атомом, способным предоставить ему 3 дополнительных электрона для завершения его внешнего уровня.
Рис.2.1.3. Заполнение энергетических уровней у s-, p-,d- и f- элементов электронами
 didi79
didi79
Я Леди.
2.5 Химическая реакция между элементами
Когда атомы сближаются, то в первую очередь они взаимодействуют друг с другом не ядрами, а электронами. Число электронов определяет способность атома образовывать связи с другими атомами, то есть его химические свойства.
Внешним уровнем атома называется самый далекий от ядра уровень, на котором еще есть электроны.
Именно эта оболочка соприкасается при столкновении с внешними уровнями других атомов в химических реакциях.
Завершенный уровень энергетически выгоднее незавершенного, поэтому если внешний уровень не завершенный, то этот элемент будет легко реагировать с любым другим атомом, способным предоставить ему дополнительные электроны для завершения его внешнего уровня.
Рассмотрим элемент с порядковым номером 18 (аргон).
Расположим 18 электронов в следующую электронную формулу: 1s 2 2s 2 2p 6 3s 2 3p 6
Он уже имеет полностью завершенный внешний уровень и, следовательно, не склонен реагировать с другими элементами.
Действительно, химическое поведение аргона настолько выделяется своей пассивностью среди других элементов, что он получил название инертного газа или благородного газа.
Рассмотрим элемент с порядковым номером 7 (азот).
Расположим 7 электронов в следующую электронную формулу: 1s 2 2s 2 2p 3
2-й (внешний) электронный уровень азота заполнен электронами не до конца (на нем 2 + 3 = 5 электронов) и до полного заполнения не хватает трех электронов.
При взаимодействии с другими атомами азот способен принять 3 дополнительных электрона на свой внешний уровень.
Правило октета
Атомы элементов стремятся к наиболее устойчивой электронной конфигурации.
Устойчивой является электронная конфигурация с завершенным внешним электронным уровнем из (s2 + p6), т.е. из октета электронов.
Исключением является лишь один элемент Гелий (порядковый номер 2) имеет завершенную внешнюю оболочку из 2-х электронов ( 1s 2 ).
На самом нижнем уровне помещается только одна s-орбиталь, на которой можно разместить не более двух электронов. Это завершенная электронная оболочка.
Донорные и Акцепторные свойства атомов.
Отдавая или принимая электроны, нейтральные атомы стают ионами.
Чем внешний уровен дальше от ядра, тем сильнее проявляются акцепторные и донорские свойства атомов.







 didi79
didi79