Что значит нет фолликул
Прорыв в лечении бесплодия
Прорыв в лечении бесплодия
Овуляция и дальнейшее оплодотворение возможны при наличии в яичниках женщины абсолютно жизнеспособных фолликулов
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Процент женщин, лишенных радости материнства, с каждым годом возрастает. Среди причин бесплодия всё чаще выделяют первичную недостаточность яичников (ПНЯ). Данная патология заключается в отсутствии фолликулов или нарушении их созревания в ответ на гормональную стимуляцию. Решение проблемы эндокринного бесплодия вследствие синдрома истощения яичников предложили ученые из США и Японии. Им удалось активировать фолликулы яичников в условиях in vitro и имплантировать фрагменты ткани в верхний отдел фаллопиевых труб, что дает женщине шанс стать матерью.
Конкурс «био/мол/текст»-2013
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2013 в номинации «Лучшее новостное сообщение».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Корни проблемы
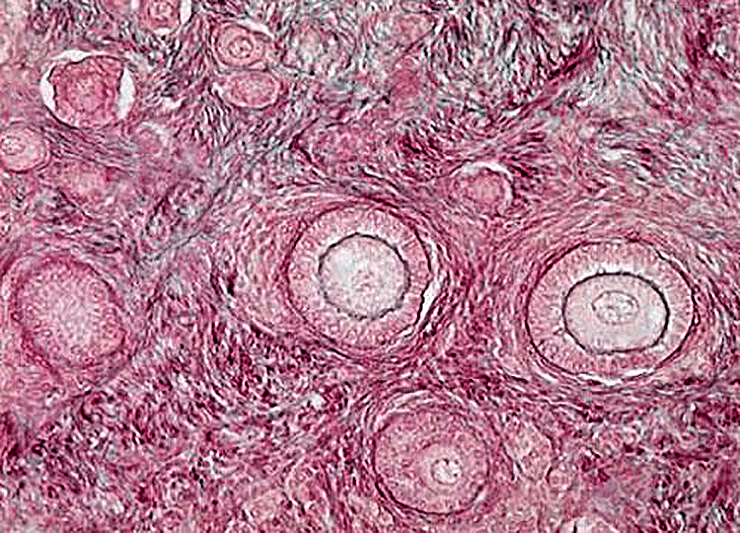
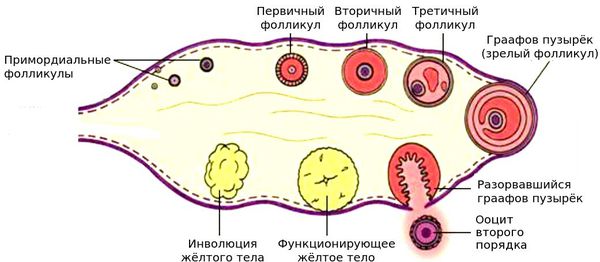
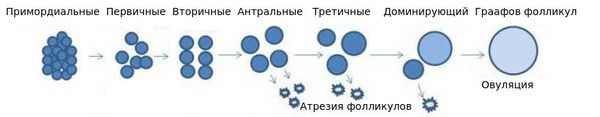
Яичник — уникальная эндокринная система, в которой ежемесячно возникает новая секреторная структура — граафов фолликул (рис. 1). Он развивается из микроскопического примордиального фолликула, потенциальная функциональность которого и определяет регулярность менструального цикла женщины.
Рисунок 1. Фолликулы яичников
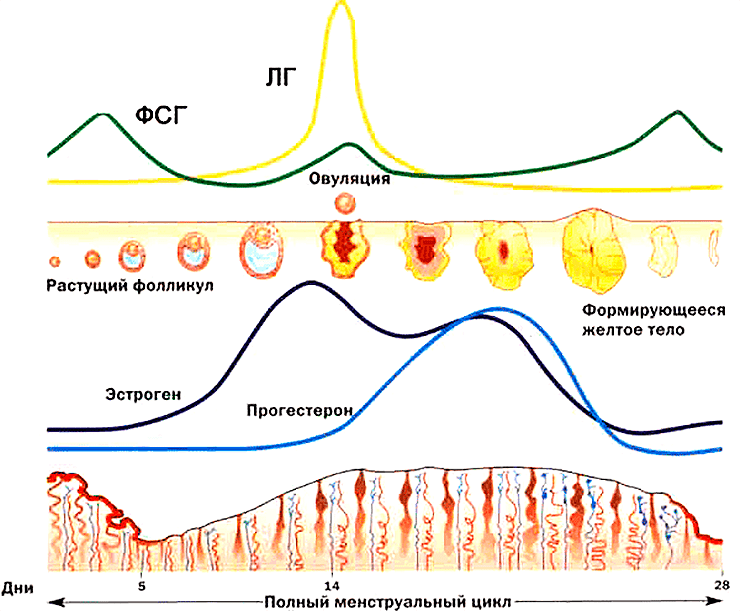
Функция яичников регулируется двумя гормонами гипофиза: фолликулостимулирующим гормоном (ФСГ) и лютеинизирующим гормоном (ЛГ) (рис. 2). В свою очередь, яичники продуцируют гормоны, регулирующие секрецию ФСГ и ЛГ по принципу отрицательной обратной связи: эстрогены, ингибины и прогестерон [1].
Рисунок 2. ФСГ стимулирует рост и созревание фолликула в яичнике. ЛГ стимулирует выход созревшей яйцеклетки из фолликула (овуляцию).
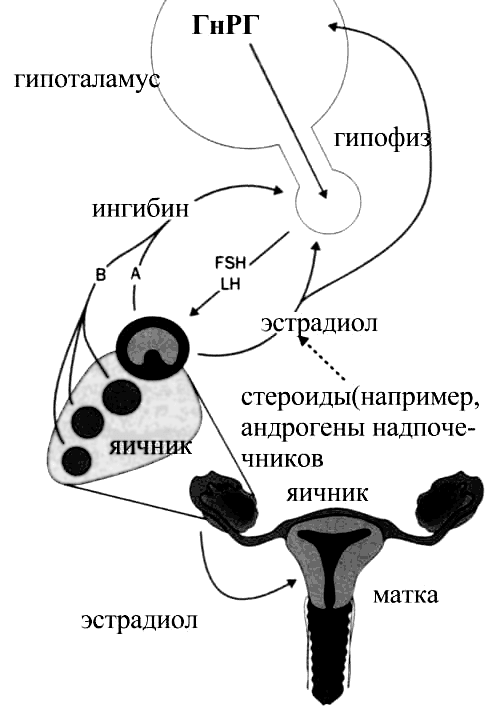
При недостаточности функции яичников для поддержания снижающейся концентрации яичниковых гормонов происходит резкое повышение секреции гонадотропинов. За их выработку отвечает гипоталамус (рис. 3).
Рисунок 3. Связь функционирования яичников с эндокринной системой
Причины, приводящие к развитию первичной недостаточности яичников (ПНЯ), весьма гетерогенны: генетические, ферментативные, аутоиммунные, инфекционно-токсические, психогенные. Кроме того, в эту группу относят и дефекты в структуре гонадотропинов. В последние годы большое внимание исследователей уделяется молекулярно-генетическим аспектам этой патологии яичников, поскольку выявлен определенный набор генов, который может отвечать за развитие ПНЯ.
Стоит отметить, что термин «первичная недостаточность яичников» в настоящее время применяется для определения состояния, которое ранее называли «преждевременной менопаузой». Ключевое различие заключается в том, что термин «ПНЯ», предложенный еще в 1942 году, характеризует нарушение функции яичников в динамике, а не конечное состояние, что наблюдается при менопаузе [1].
Диагностика
Яичниковая недостаточность диагностируется по повышенному уровню ФСГ и ЛГ в крови при сниженном уровне эстрогенов. Самый чувствительный гормон — ФСГ; он является самым ранним маркером преждевременного старения яичников. При двукратном превышении уровня ФСГ (20 Ед/л) наступление и благополучный исход беременности маловероятны.
Клинические характеристики состояния: аменорея (отсутствие менструации) ≥4 месяцев у женщин моложе 40 лет, бесплодие и повышение уровня ФСГ до менопаузальных значений (дважды с промежутком не менее 1 месяца).
Частота спонтанной недостаточности яичников у женщин с хромосомным набором 46 ХХ составляет около 1%; при этом эпидемиологические исследования указывают на тесную связь данного нарушения с возрастом. Так, у женщин в возрасте до 20 лет ПНЯ встречается с частотой 1:10000, а в возрасте от 30 до 40 — 1:1000.
Что происходит на гормональном уровне
Один из половых гормонов — 17β-эстрадиол (рис. 4), который играет важную роль в выполнении репродуктивной функции женщины, — вырабатывается преимущественно в яичниках из мужских половых гормонов — андростендиона и тестостерона [2]; небольшое количество этого гормона также вырабатывается надпочечниками. В процессе угасания функций яичников количество растущих фолликулов в них уменьшается, что приводит к значительному понижению выработки 17β-эстрадиола. Поэтому у женщин с так называемым синдромом истощения яичников наблюдается нехватка этого гормона, которая частично компенсируется большей выработкой 17β-эстрадиола в надпочечниках. Так как менструации становятся нерегулярными, уровень 17β-эстрадиола начинает колебаться, и с прекращением менструаций резко понижается, что приводит к повышению фолликулостимулирующего гормона (ФСГ).
Рисунок 4. β-эстрадиол (кристаллы). Поляризация LM X100.
Механизм активации незрелых фолликулов
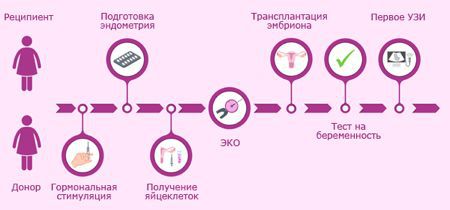
Для женщин, страдающих бесплодием по причине рассмотренного заболевания, существует единственная возможность материнства — имплантация оплодотворенной донорской яйцеклетки. Однако группа специалистов из Стэнфордского университета (США) и Медицинского факультета Университета им. Святой Марианны (Япония) предложили альтернативу — метод, позволяющий исключить известные хирургические вмешательства для стимуляции овуляции, такие как клиновидная резекция яичников или лазерное сверление. Врачи удалили яичники у участниц исследования, поделили их на несколько частей, а затем воздействовали на фрагменты яичников препаратами, стимулирующими рост. Спустя несколько дней некоторые из фрагментов ткани были имплантированы в фаллопиевы трубы женщин. Затем специалисты наблюдали за развитием фолликулов. У некоторых участниц исследования сформировались зрелые яйцеклетки, что позволило провести им стандартную процедуру экстракорпорального оплодотворения (ЭКО [3]). Результаты исследования опубликованы в журнале Proceedings of the National Academy of Sciences [4].
Важно отметить, что возможность провести подобное лечение возникла благодаря изучению сигнального клеточного пути под названием Hippo [5], который представляет собой один из ключевых компонентов регуляции таких важных процессов, как контактное ингибирование роста клеток и связанного с ним контроля размера внутренних органов [6]. Первоначально белковый комплекс Hippo был открыт у дрозофил. Мухи, у которых его функционирование было нарушено, буквально увеличивались в размерах (из-за чего регулятор и получил своё название: «Hippo» происходит от слова «гиппопотам»). Затем его обнаружили и у млекопитающих.
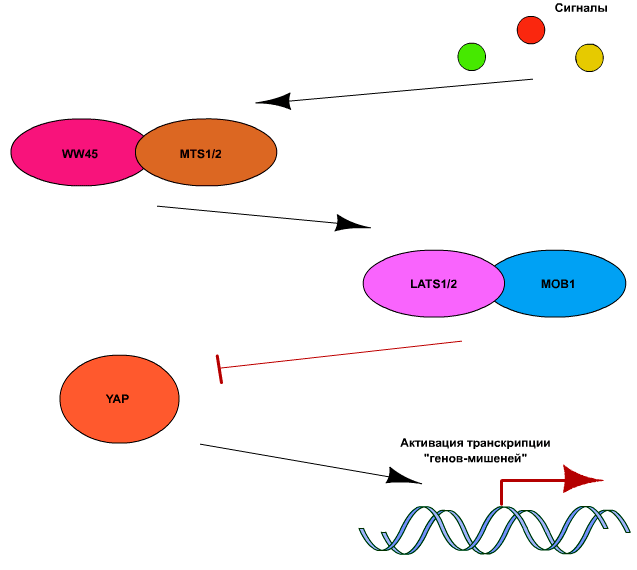
Ключевым компонентом пути Hippo является киназа Yap (Yes-activated protein), которая в активном состоянии способна связывать ряд факторов транскрипции, таких как p73, p53-binding protein-2 (p53BP2), RUNX2, SMAD7, ERBB4, PEBP2а и TEAD/ТЕF [7]. Регуляция активности YAP осуществляется в основном за счет ингибирующего действия киназ LATS1 и 2 (large tumor supressor-1 и −2). Они, в свою очередь, активируются киназами МSТ1 и МSТ2 (mammalian sterile-20-like kinases). Для полной активации LATS и МSТ необходимо также, чтобы они были связаны с адапторными белками WW45 и МОB1, соответственно. Вышеописанная часть сигнального пути Hippo является высококонсервативной у млекопитающих, в то время как сигналы активации или ингибирования LATS и МSТ могут быть достаточно разнообразными. В общих чертах сигнальный путь Hippo представлен на рис. 5.
Рисунок 5. Схематичное изображение работы сигнального белкового регулятора Hippo
Развитие эмбриона, деление эмбриональных клеток и рост тканей и органов эволюционно контролируются работой различных регуляторов. По словам одного из авторов исследования Арона Сюэ (Aaron Hsueh) — акушера-гинеколога из Стэнфордского Университета в Калифорнии — у женщин с синдромом истощения яичников наблюдается повышенная активность регулятора Hippo [8]. Другими словами, он блокирует созревание практически всех фолликулов яичника, что минимизирует возможность наступления овуляции и дальнейшего оплодотворения.
Ученые нарушили работу сигнального пути Hippo в удаленных яичниках и, таким образом, предотвратили преждевременную остановку развития фолликулов. Далее специалисты стимулировали активность другого сигнального пути, называемого Akt, что способствовало ускорению роста фолликулов [9], [10].
Клинические исследования проводились сначала на лабораторных животных. На следующем этапе в эксперименте согласились принять участие 27 женщин, страдающих от первичной дисфункции яичников. В ходе исследования выяснилось, что у некоторых женщин в яичниках не было фолликулов. В яичниках 13 пациенток обнаружили незрелые фолликулы; из них у восьми женщин применение нового метода лечения способствовало росту жизнеспособных фолликулов. Для 14 женщин лечение оказалось неэффективным.
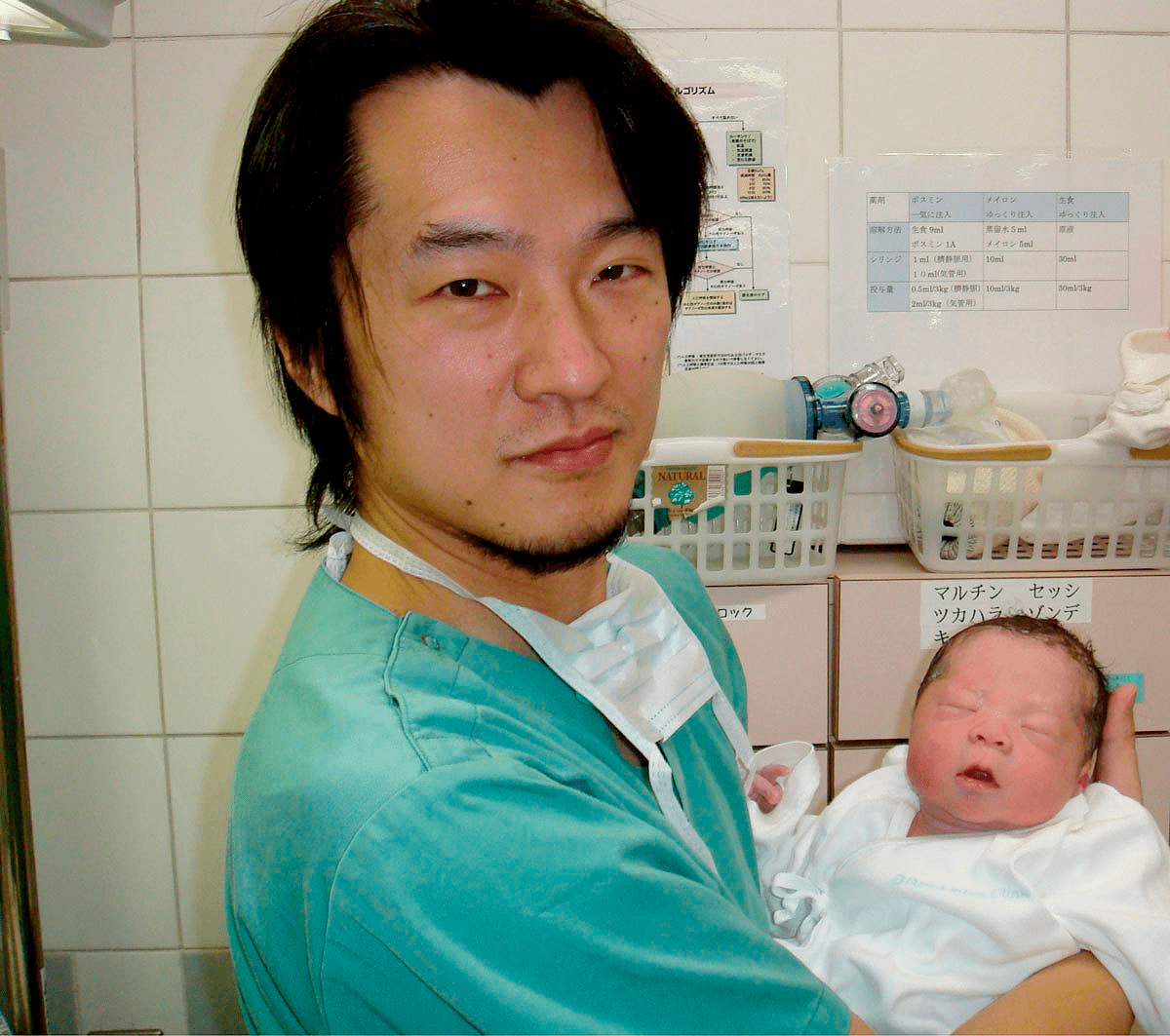
В результате зрелые яйцеклетки были получены у пяти женщин и использованы для ЭКО. Одна из пациенток в возрасте 29 лет во время курса лечения на 37 неделе беременности родила ребенка весом 3,3 кг (рис. 6). Научная группа надеется, что эффективность нового метода лечения достигнет 30%. И, более того, по их словам, этот метод может также помочь женщинам, перенесшим лучевую или химиотерапию, и пациенткам в возрасте лет с нерегулярным менструальным циклом [11].
Рисунок 6. Казухиро Кавамура (Kazuhiro Kawamura) — один из ученых, участвовавший в исследовании — держит на руках новорожденного мальчика, которого родила первоначально бесплодная женщина
Мнения и прогнозы
По мнению Марчелле Цедарса (Marcelle Cedars) — специалиста в области репродуктивной онкологии из Университета Калифорнии в Сан-Франциско — исследователи поторопились апробировать новый метод лечения бесплодия на человеке: «Ученые продемонстрировали рождение здорового потомства при проведении предварительных исследований на мышах, но не было получено доказательств роста, развития и/или плодовитости этого поколения» [12].
Авторы исследования полагают, что метод подходит бесплодным женщинам среднего возраста, а также тем, кому диагностировали первичную недостаточность яичников, вследствие которой в более чем 50% случаев беременность не наступает. Однако не все эксперты разделяют их оптимизм. Руководитель врачебной группы, изучающей оплодотворение, из Университета Южной Калифорнии Ричард Паульсон (Richard Paulson) убежден, что ключевое условие эффективности разработанного механизма лабораторной «активации» фолликула — наличие в нем здоровой яйцеклетки. Кроме того, Паульсон заостряет внимание на том, что неразумно сопоставлять результаты лечения женщины в возрасте 29 лет с результатами лечения женщины в 40 лет, поскольку гормональная стимуляция роста и развития фолликулов в разные возрастные периоды происходит с различной интенсивностью.
Рассмотренный консервативный метод стимуляции овуляции путем блокировки сигнального пути Hippo в отдельных фрагментах ткани яичников может быть полезен женщинам, больным раком или проходящим процедуры стерилизации. Но все же главное достижение ученых — это рождение ребенка у женщины, которая без их участия никогда не смогла бы стать матерью.
Синдром пустых фолликулов
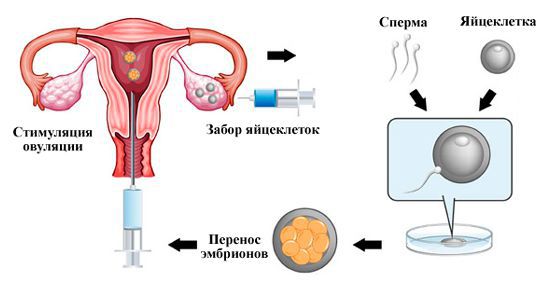
Процедура ЭКО (экстракорпоральное оплодотворение) — это современный и многоэтапный процесс, который позволяет получить беременность и ребенка в тех случаях, когда физиологическое наступление беременности невозможно. При проведении экстракорпорального оплодотворения могут возникать проблемы, одной из которых является синдром пустого фолликула.
Стаж работы 11 лет.
Что такое синдром пустых фолликулов
Может ли фолликул быть пустым? Синдром пустых фолликулов — это патологическое состояние, которое возникает при проведении протокола экстракорпорального оплодотворения, при котором после пункции фолликулов в фолликулярной жидкости не обнаруживается яйцеклеток.
При физиологическом состоянии женской репродуктивной системы фолликулы растут, созревают, в них формируется зрелая яйцеклетка. При стимуляции овуляции таких фолликулов может быть несколько (от двух до двадцати и более). После пункции в протоколе экстракорпорального оплодотворения из каждого фолликула получают фолликулярную жидкость, в которой присутствуют ооциты. Если же при пункции фолликулы пустые, то есть, в них нет половых клеток женщины, тогда можно говорить о присутствии синдрома пустых фолликулов.
Чем моложе женщина, тем меньше риск формирования такого патологического состояния. У молодых девушек риск формирования такого состояния составляет до 1%. С возрастом этот показатель может увеличиваться до 9%.
Впервые такое состояние было выявлено врачом-репродуктологом Каролиной Калам в 1986 году. Именно этот специалист разделил синдром пустых фолликулов на два вида: истинный и ложный синдром пустых фолликулов.

Причины пустых фолликулов
Почему в фолликуле нет яйцеклетки? Точных причин, почему возникает пустой фолликул без яйцеклетки, на данный момент нет. Существует несколько предположений, которые могут привести к соответствующим нарушениям в репродуктивной системе женского организма.

Как диагностируют синдром пустых фолликулов?
Может ли быть фолликул без яйцеклетки быть выявлен заранее?
Мнение врача
К сожалению, пустой фолликул диагностировать до пункции нельзя ни проведением измерений базальной температуры, ни при помощи ультразвукового исследования. Диагноз ставится только на основании изучения фолликулярной жидкости после проведения процедуры его пунктирования.
Врач репродуктолог, акушер-гинеколог.
Некоторые специалисты настаивают на том, что синдром пустых фолликулов не является отдельным заболеванием, а лишь следствие каких-либо патологий.
Чтобы диагностировать истинный синдром пустых фолликулов, необходимо исключить причины, которые могли бы повлиять на формирование такого состояния:
Терапия при синдроме пустых фолликул
Если диагностировано отсутствие фолликулов в яичниках, необходимо предпринимать меры для выявления влияния факторов и причин такого состояния, а в последующем исключить их воздействие на организм женщины. После этого проводится повторная гормональная нагрузка на яичники с последующей повторной пункцией фолликулов.
Если же и при повторной процедуре в фолликулярной жидкости не обнаруживается ооцитов, тогда необходимо предпринимать следующие меры:
Синдром пустых фолликулов не является приговором. При грамотном подборе гормональной стимуляции и исключении всех факторов риска наступление беременности в протоколе ЭКО не заставит себя долго ждать. Ведь истинный синдром пустых фолликулов встречается достаточно редко.
Что делать, если нет яйцеклеток даже после применения всех мер?
Если были выполнены все рекомендации и в итоге нет ооцитов в фолликуле или нет фолликулов в яичниках, то современные вспомогательные репродуктивные технологии могут помочь вам в обретении счастья материнства.
В современных центрах есть криобанки, в которых вы сможете подобрать донорские яйцеклетки. Сотрудники центра помогут подобрать клетки от такого донора, который имеет максимальные фенотипические (внешние) сходства с вами.
Данная статья не может быть использована для постановки диагноза, назначения лечения и не заменяет прием врача.
«Резерв фолликулов в яичниках может исчерпаться уже к 30 годам, и тогда забеременеть не получится». Интервью с гинекологом
Что такое овариальный резерв, почему о нем важно знать, какие анализы нужно сдать, чтобы определить количество фолликулов, без которых невозможна беременность, и кто находится в зоне риска? На эти вопросы нам ответила врач акушер-гинеколог Тамара Слукина.
Все начинается еще до рождения девочки
— Тамара Владимировна, все чаще говорят о том, что первого ребенка женщины решаются родить лишь примерно с 27 лет, так ли это?
— Да, действительно, такая тенденция существует, и она не очень радует гинекологов. В последнее время отмечается смещение возрастных границ для первородящих.
— Почему так происходит?
— Причин много: урбанизация, желание получить высшее образование (а иногда даже два), состояться в социальном и профессиональном плане, удостовериться в правильном выборе партнера и так далее.
— Какой возраст считается самым благоприятным для беременности?
— Определенно, лучшее время для первой беременности — до 25 лет, когда организм крепкий и здоровый, когда нет серьезных приобретенных болезней и минимально пагубное влияние стрессовых факторов.
— Что такое фолликул и овариальный резерв?
— Фолликул — это структурный компонент яичника, состоящий из яйцеклетки, окруженной слоем эпителиальных клеток и двумя слоями соединительной ткани. Он выполняет защитную функцию для яйцеклетки, а также гормональную.
Овариальным резервом называют запас имеющихся в яичнике фолликулов, способных развиваться далее и делающих возможным овуляцию яйцеклетки.
К сожалению, число фолликулов конечно. Еще в утробе приблизительно к 19-20 неделе в яичниках плода начинают формироваться оогонии, то есть предшественники фолликулов. Их закладывается порядка 7 миллионов, к моменту рождения девочки количество сокращается уже до 1,5-2 миллионов. К периоду первой менструации остается не более 300-350 тысяч, и постепенно количество уменьшается.
Наивысшая генеративная активность, то есть реализация максимального числа яйцеклеток, биологически запрограммирована на третье десятилетие жизни женщины.
Вероятность забеременеть после 30 сокращается вдвое
— Какое количество фолликулов говорит о том, что у женщины хороший запас и пока беспокоиться не стоит?
— Примерно 5-15 фолликулов размером от 3 до 5 мм считается нормальным. Если их меньше, ситуацию можно назвать критичной и стоит обязательно обратить внимание на этот вопрос.
— Правда ли, что сегодня резерв у женщин заканчивается намного раньше, чем, например, лет десять назад?
— Паниковать пока рано. Если исходить из личного опыта, я бы не сказала, что ситуация становится очень критичной, но до 30 лет вероятность забеременеть самая высокая и, желательно, конечно, чтобы первые роды прошли в этот период.
По статистике, количество фертильных женщин за отметкой в 30 лет сокращается ровно наполовину, то есть вероятность забеременеть значительно снижается. Еще сложнее ситуация с новым десятком: в возрасте 40-43 лет количество представительниц прекрасного пола, способных забеременеть, — уже 10-15%. Ну, а среди 50-летних дам — это и вовсе уникальные случаи.
Точно оценить овариальный резерв сегодня не проблема
— Почему природа так неравноценно распределила: у одних резерв больше, у других — меньше?
— Таковы генетические программы. Кому-то повезло, а кому-то — нет. Повлиять на это, каким-то образом увеличить запас организма нельзя. Как я уже говорила, процесс необратим.
— Какие существуют методы определения овариального резерва?
— Есть 3 составляющие: проверка АМГ, подсчет количества фолликулов на УЗИ, а также определение размера (объема) яичников.
Определение антимюллерова гормона (АМГ) по анализу крови. Это белок, продуцирующийся в гранулезных клетках фолликула. Как правило, показатель выше 2,5 нг/мл считается нормой.
Показания УЗИ. Собственно подсчет фолликулов и определение объема яичников (если они меньше 4 см, то есть вероятность, что овариальный резерв маловат).
Поговорите с мамой и старшими сестрами. Предрасположенность к раннему климаксу — очень важный фактор
— Как часто нужно делать специальные обследования, чтобы держать ситуацию под контролем?
— В зоне риска женщины, перенесшие операции, лучевую терапию, химиотерапию, воспалительные процессы, затрагивающие репродуктивные органы, и особенно, если есть эндометриоз. Им стоит быть очень внимательными.
Что касается остальных, скажем так, по протоколу, после 35 лет женщина должна делать УЗИ каждый год. Ранее — только по определенным показаниям. Но никто не мешает вам обследоваться и раньше, чтобы просто удостовериться, что все хорошо. Сделать это можно хотя бы для исключения синдрома аномального истощения яичников — прекращения выработки яйцеклеток, опередившее процесс старения, который развивается на фоне наследственной предрасположенности. В таких случаях резерв может быть крайне критичным даже к 30-35 годам.
Если у вашей мамы или у старших сестер был очень ранний климакс, значит высока вероятность, что и вы пойдете по тем же стопам. Еще один важный сигнал — частые сбои менструального цикла. Его нельзя игнорировать.
К сожалению, сильное пагубное влияние сегодня оказывает экология и вообще все, что нас окружает. Возьмем хотя бы обычные пластиковые бутылки, в которых содержится бисфенол. Под действием температуры выше 35 градусов он становится эстрогеноподобным. Если такое вещество попадает в организм женщины, оно оказывает крайне негативное влияние на фолликулы. То есть полежала бутылочка на солнышке — и вот еще один негативный фактор в копилку. В некоторых странах подобные тары уже запрещены.
— Главный вопрос: что со всем этим делать?
— Необходимо как минимум вовремя обратить внимание на проблему. Не стоит ее очень сильно пугаться и паниковать. Ненадолго приостановить процесс врачи все-таки могут. Как правило, с помощью гормональных препаратов.
О профилактике тоже можно говорить. Избегайте абортов, любых воспалительных процессов, если уж они возникают, обязательно обращайтесь к врачам, не затягивайте. Будьте внимательны к себе и своему здоровью.
Что такое снижение овариального резерва? Причины возникновения, диагностику и методы лечения разберем в статье доктора Каменецкого Б. А., репродуктолога со стажем в 30 лет.
Определение болезни. Причины заболевания
Распространение вспомогательных репродуктивных технологий привело к тому, что овариальный резерв и его снижение рассматриваются с позиций ответа яичника на воздействие гонадотропных препаратов. Гонадотропины — группа препаратов, оказывающих влияние на половые железы, в том числе способствующие созреванию фолликулов в яичниках. Нормальный овариальный резерв — адекватному ответ яичников на стимуляцию. Под адекватным ответом понимается требуемый рост фолликулов и получение достаточного количества ооцитов. Достаточное количество определяется не столько числом получаемых ооцитов, сколько количеством полученных после оплодотворения эмбрионов с правильным хромосомным набором.
В зависимости от возраста женщины для получения одного нормального эмбриона требуется разное количество ооцитов:
Причины развития СОР можно условно разделить на две группы:
Симптомы снижения овариального резерва
Снижение овариального резерва — процесс, растянутый во времени, которые чаще всего протекает без симптомов. Причиной, заставляющей женщину обратиться к врачу, является отсутствие беременности (бесплодие).
Патогенез снижения овариального резерва
К другим причинам, оказывающим негативное влияние на уровень овариального резерва, относятся:
Классификация и стадии развития снижения овариального резерва
С накоплением данных стало понятно, что в группу пациентов со сниженным овариальным резервом, а как следствие с неадекватным ответом на стимулирующую терапию, включены женщины с разными причинами возникновения и механизмами развития патологии. Это затрудняло планирование адекватной терапии. В связи с этим в 2016 году была сформирована рабочая группа POSEIDON ( Patient-Oriented Strategies Encompassing Individualize Oocyte Number) [37] по разработке новых критериев и классификации пациентов со сниженным овариальным резервом и бедным ответом яичников на стимуляцию.
Чтобы представить более детальную картину, были предложены клинически значимые критерии, которые могут помочь врачу в ведении пациентов. Для определения групп с низким прогнозом на стимуляцию предложены две новые категории [37] :
Первая группа включает количество получаемых при стимуляции ооцитов:
Вторая группа объединяет «качественные» и «количественные» параметры, а именно:
В результате введения этих категорий выделяют четыре группы пациентов со сниженным овариальным резервом и низким ответом на стимулирующую терапию:
Выделение отдельных групп решает практическую задачу — планирование терапии с учётом детальных критериев для пациентов разных этиопатогенетических групп.
Осложнения снижения овариального резерва
Вторым по значимости осложнением является преждевременное истощение яичников и, как следствие, нарушение менструальной функции вплоть до её полного угасания. Снижение овариального резерва приводит к критическому снижению количества ооцитов и нарушение менструального цикла по типу:
Диагностика снижения овариального резерва
Диагностика строится на совокупности анамнестических и клинико-лабораторных данных. Наиболее важным является возраст. Клинические проявления снижения овариального резерва зачастую начинают проявляться после 35 лет.
Очень часто в анамнезе есть упоминания о раннем наступлении климакса у ближайших родственников по женской линии (мать, старшие сестры).
Основными жалобами являются нарушение (чаще сокращение продолжительности и интенсивности) менструального цикла и бесплодие.
Из объективных критериев:
Лечение снижения овариального резерва
Патогенетического лечения не существует. Терапия направлена прежде всего на устранение последствий снижения овариального резерва, а именно преодоления бесплодия.
В программах вспомогательной репродукции в зависимости от принадлежности пациентки к той или иной группе по критериям POSEIDON рассматриваются различные стратегии стимулирующей терапии для получения большего количества ооцитов.
Для первой и второй групп применяется пять основных стратегий отдельно или в комбинациях:
Стратегии, предложенные для стимуляции пациенток третьей и четвёртой групп:
При невозможности получения достаточного количества ооцитов рекомендовано использование донорских ооцитов.
Прогноз. Профилактика
Для профилактики бесплодия рекомендовано:
Профилактика ятрогенных осложнений: