Что означает стабилизация процесса в онкологии
Что означает стабилизация процесса в онкологии
1. Сокращения:
• Критерии оценки ответа солидных опухолей на лечение (RECIST)
2. Определение:
• Новая версия критериев была опубликована в 2009 г.
• Используются модифицированные критерии RECIST
3. Ключевые принципы:
• Критерии включения пациентов:
о Пациенты с наличием измеряемых проявлений заболевания при первичном исследовании
— Наличие как минимум одного измеряемого очага
о Первичной конечной точкой является оценка объективного ответа опухоли на лечение
• Оценка опухоли при первичном исследовании:
о Обнаружение измеряемых проявлений заболевания
о Выбор целевых и нецелевых очагов
о Измерение целевых очагов
о Опухолевая нагрузка: сумма размеров целевых очагов
• Оценка опухоли при повторном исследовании:
о Измерение целевых очагов
о Оценка нецелевых очагов
о Обнаружение новых очагов
о Расчет ответа опухоли на лечение в данной временной точке
4. Существенные различия между RECIST и RECIST 1.1:
• Внесены изменения в определения следующих понятий:
о Опухолевая нагрузка
о Размер лимфатических узлов
о Прогрессирование заболевания
о Прогрессирование неизмеряемых проявлений заболевания о Подтверждение ответа о Новые очаги



б) Лучевая анатомия:
1. Измеряемые и неизмеряемые проявления заболевания:
• Измеряемые проявления:
о Опухоль с наибольшим диаметром (LD) > 10 мм, измеренным при КТ или МРТ в аксиальной плоскости с интервалом реконструкции 5 мм LD должен превышать толщину среза как минимум в два раза
о Опухоль с наибольшим диаметром (LD) >20 мм, измеренным при рентгенографии органов грудной клетки (если очаг имеет четкий контур и окружен воздушной легочной тканью)
— Предпочтительнее проводить КТ
о Опухоль с наибольшим диаметром (LD) > 10 мм, измеренным клинически (по фотографии) электронным штангенциркулем:
— На фотографиях на кожных покровах следует располагать линейку
— Образования, размер которых не удается с точностью определить с помощью штангенциркуля, следует считать неизмеряемыми
о Размер лимфатических узлов по короткой оси при КТ должен составлять > 15 мм (толщина среза 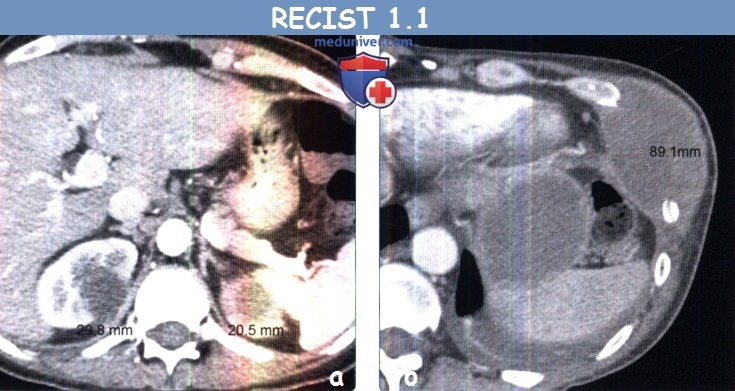
(б) Мужчина 47 лет с метастазами немелкоклеточного рака легкого. При КТ с контрастным усилением в грудной стенке визуализируется метастаз. В соответствии с RECIST 1.1 метастазы в костях считаются целевыми очагами только в том случае, если содержат мягкотканный компонент, отвечающий критериям размера. 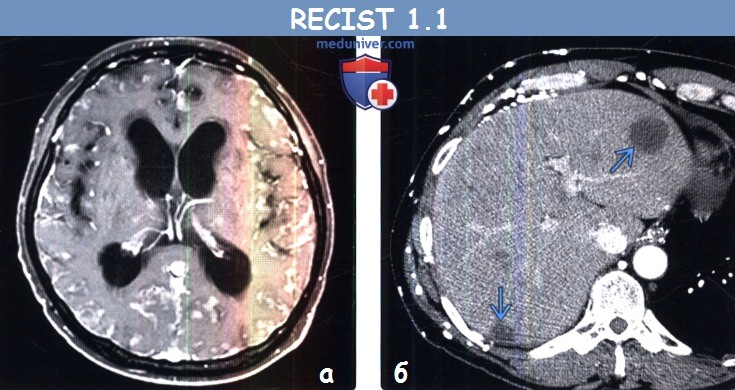
(б) Мужчина 4 7 года с метастазами муцинозной аденокарциномы легкого. При КТ с контрастным усилением в печени визуализируется гиподенсный кистозный метастаз, расцененный как измеряемый очаг. 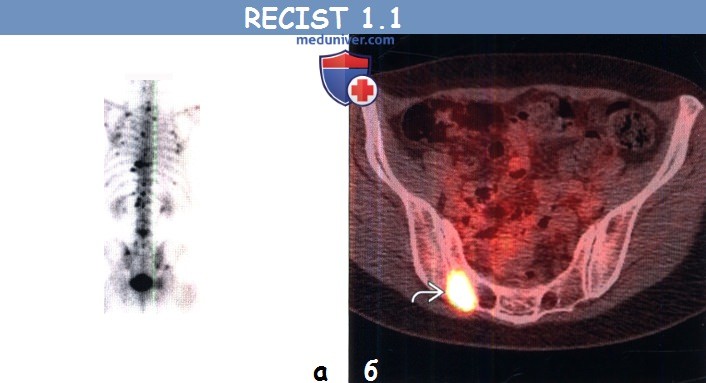
(б) Пациент, страдающий немелкоклеточным раком легкого. При ФДГ-ПЭТ/КТ в правой половине крестца визуализируется очаг с повышенным уровнем поглощения ФДГ. При КТ в данной области патологический участок не выявлен. Остеосцинтиграфия и ПЭТ/КТ могут быть использованы для обнаружения метастазов в костях, но не для их измерения.
1. Ключевые принципы:
• Измерение ранее выбранных целевых очагов (даже если их размер перестал быть наибольшим)
• Оценка всех ранее выбранных нецелевых очагов
• Оценка новых очагов
2. Оценка целевых очагов:
• Расчет SLD:
о Измерение LD каждого целевого очага
о Измерение размера целевых лимфатических узлов по короткой оси
о Если размер образования слишком мал для того, чтобы быть измеренным, считают, что его размер составляет 5 мм (величина по умолчанию)
о Если образование исчезло, считают его размер равным 0
о Распадающиеся или сливающиеся очаги:
— Если целевой очаг распадается на множество меньших по размеру фрагментов, то суммируются LD всех фрагментов
— Если целевые очаги сливаются, то используется LD конгломерата
3. Новые очаги:
• Новые очаги должны быть исключительно опухолевой этиологии:
о Сомнительные очаги, возникновение которых обусловлено разницей в методиках исследования или потенциально неопухолевым процессом, не учитывают
о Не обязательно должны быть измеряемыми
• Сомнительные очаги:
о Оценивают повторно при исследовании в следующей временной точке
о Если наличие очага подтверждается при повторном исследовании, то регистрируется прогрессирование заболевания по дате первого выявления такого очага
• Очаги, обнаруженные за пределами зоны первичного исследования, считают новыми
• Наличие новых очагов, выявленных при УЗИ, следует подтвердить с помощью КТ или МРТ
4. Общий ответ:
• Категории:
о Полный ответ (CR)
о Частичный ответ (PR) о Стабилизация заболевания (SD)
о Оценка невозможна (NE) о Прогрессирование заболевания (PD)
5. ФДГ-ПЭТ и ПЭТ/КТ:
• Критерий «положительного» результата при ПЭТ:
о Уровень поглощения ФДГ образованием в два раза превышает уровень поглощения ФДГ окружающими тканями при выполнении исследования с коррекцией аттенуации сигнала
• Влияние на категории ответа:
о Отрицательный результат при первичной ПЭТ и положительный результат при повторной ПЭТ: прогрессирование заболевания (новый очаг)
о Отсутствие первичной ПЭТ и положительный результат при повторной ПЭТ: прогрессирование заболевания:
— Требует подтверждения наличия очага по данным КТ
При подтверждении наличия очага регистрируется прогрессирование заболевания по дате выполнения первой ПЭТ
о Ключевая особенность:
— При отсутствии первичной ПЭТ и положительном результате повторной ПЭТ наличие выявленного ранее при КТ очага без признаков прогрессии не следует расценивать, как прогрессирование заболевания
6. Ошибочная оценка и случаи, когда оценка невозможна:
• NE: все очаги не могут быть оценены в определенной временной точке:
о Обычно причиной служит потеря данных или низкое качество изображений
о Также данная категория ответа соответствует невозможности оценки некоторой части очагов:
— Исключение: если данные очаги не повлияют на оценку ответа на лечение в определенной временной точке
7. Рецидивирование очагов:
• Влияние рецидивирования очагов зависит от общего ответа:
о Стабилизация заболевания/частичный ответ:
— Образование, подвергшееся обратному развитию, а затем рецидивировавшее, продолжает учитываться
— Категория ответа зависит от состояния других очагов
о Полный ответ
— Рецидивирования образования свидетельствует о прогрессировании заболевания
8. Подтверждение ответа на лечение:
• Частичный ответ/полный ответ:
о Подтверждение необходимо в случае нерандомизированных клинических исследований, в которых эффективность лечения является первичной конечной точкой
о В случае стабилизации заболевания в первой промежуточной точке допускается последующее подтверждение частичного ответа
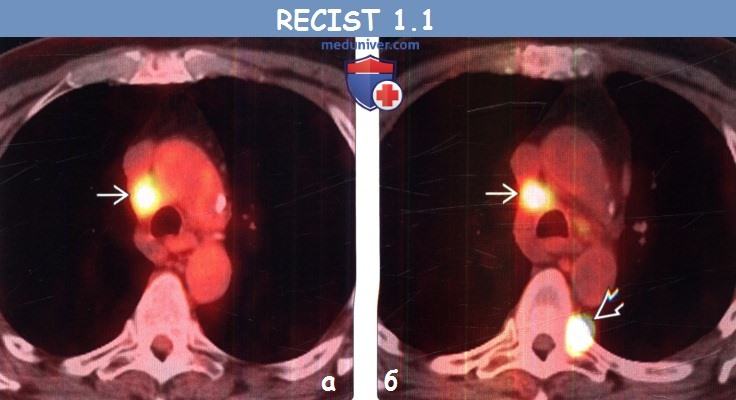
(б) У этого же пациента после курса химиотерапии при ФДГ-ПЭТ/КТ уровень поглощения ФДГ правым паратрахеальным лимфатическим узлом остался без изменений, однако в грудном позвонке возник новый интенсивно накапливающий ФДГ метастаз, что соответствует прогрессированию заболевания. 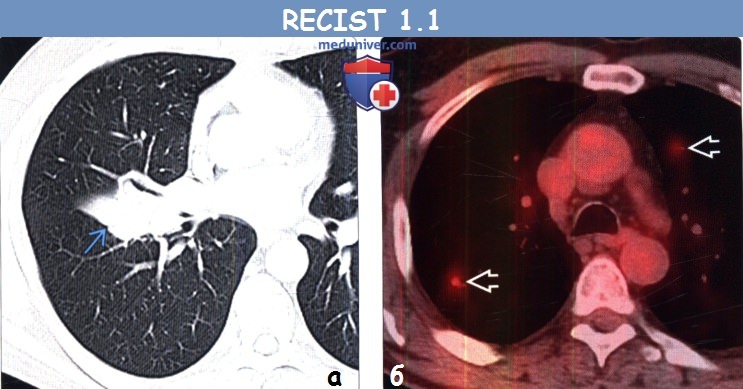
(б) У этого же пациента после курса химиотерапии при ФДГ-ПЭТ/КТ в легких визуализируются новые интенсивно поглощающие ФДГ узелки, соответствующие метастазам. Поскольку данные метастазы при первичной КТ не выявлялись, а при последующей КТ их наличие было подтверждено, то картина соответствует прогрессированию заболевания. 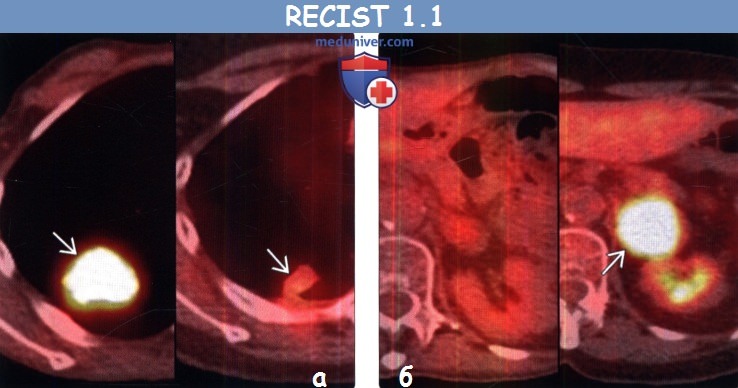
(б) У этого же пациента на совмещенных изображениях при первичной ФДГ-ПЭТ/КТ (слева) и после курса химиотерапии (справа) визуализируется возникновение интенсивно поглощающего ФДГ метастаза в левом надпочечнике, что соответствует прогрессированию заболевания.
в) Список литературы:
1. Litiere S et al: The components of progression as explanatory variables for overall survival in the Response Evaluation Criteria in Solid Tumours 1.1 database. Eur J Cancer. 50(10)4847-53, 2014
2. Nishino M et al: Revised RECIST guideline version 1,1: What oncologists want to know and what radiologists need to know. AJR Am J Roentgenol. 195(2):281-9, 2010
3. van Persijn van Meerten EL et al: RECIST revised: implications for the radiologist. A review article on the modified RECIST guideline. Eur Radiol. 20(6)4 456-67, 2010
4. Eisenhauer EA et al: New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J Cancer, 45(2):228-47, 2009
5. Eisenhauer EA et al: Response assessment in solid tumours (RECIST) and supporting papers (version 14). Eur J. Cancer. 45(2):225-310, 2009
Редактор: Искандер Милевски. Дата публикации: 24.2.2019
Случай длительной стабилизации рака поджелудочной железы на фоне 2 линий полихимиотерапии.
В статье приводятся статистические данные по заболеваемости, диагностике, лечению и выживаемости больных с раком поджелудочной железы, краткий обзор наиболее часто используемых схем полихимиотерапии при данной опухоли, а также данные клинического наблюдения случая длительной стабилизации заболевания на фоне химиотерапии и симптоматического лечения.
Рак поджелудочной железы характеризуется агрессивным течением и высоким метастатическим потенциалом, кроме того, в большинстве случаев заболевание выявляется на неоперабельных стадиях. Основным методом лечения местнораспространенного и метастатического рака поджелудочной железы является химиотерапия [1]. Наиболее часто применяемыми схемами полихимиотерапии в последние годы явились FOLFIRINOX и GEMCAP.
Рак поджелудочной железы не относится к часто встречающимся, однако статистические показатели при его выявлении и лечении на сегодняшний день представляются неудовлетворительными.
В 2018 г диагноз рака поджелудочной железы был впервые установлен у 16273 больных, Для сравнения, В 2015 г. число случаев впервые диагностированного рака поджелудочной железы (РПЖ) в России составило 8 791, и с каждым годом данный показатель неуклонно растет [2].
Доля больных, состоящих на учете 5 лет и более с момента установления диагноза в 2011 г составила 24. 2%, в 2018 – 32. 1% [2].
Индекс накопления этого контингента больных в 2011 составлял 1. 1, в 2018 – 1. 3 [2].
К сожалению, не всегда клинический диагноз подтверждается морфологическим, однако отмечается положительная динамика в этом вопросе. В 2011г удельный вес больных с диагнозом, подтвержденным морфологически, среди больных с впервые выявленным раком поджелудочной железы составил 47. 1%, а в 2018 г – уже 65. 8% [2].
На фоне роста общего показателя морфологической верификации, наименьший удельный вес морфологически верифицированного диагноза имеет рак поджелудочной железы.
Удельный вес больных I-II стадией процесса на момент диагностики заболевания в 2011 г. составлял 12%, а в 2018 г уже 19. 6 %, тем не менее оставаясь одним из самых низких среди всех злокачественных новообразований [2].
Вследствие позднего выявления и, соответственно, значительной частоте встречаемости случаев с нерезектабельной опухолью, сложности большого обьема хирургических операций при данной нозологии, достаточно тяжелом течении послеоперационного периода, относительно низкой эффективности химиотерапии, летальность больных в течение года с момента установления диагноза за последние годы снизилась незначительно: с 68. 1% в 2012г. до 66. 9% в 2018 г [2].
В целом летальность при раке поджелудочной железы составляет 5. 8% среди смертности от всех злокачественных новообразований. [2]
КРАТКИЙ ОБЗОР ХИМИОТЕРАПИИ
Учитывая, что в большинстве случаев заболевание выявляется на неоперабельной стадии, основной целью лечения становится контроль симптомов заболевания и увеличение продолжительности жизни пациента [3]
Стандартом лечения пациентов с метастатическим РПЖ до середины 1990-х гг. являлся 5-фторурацил в монорежиме или в комбинации с другими препаратами [4- 6].
В 1997 г. гемцитабин был одобрен в качестве монотерапии для данной патологии после того, как Burris с соавт. Опубликовали результаты рандомизированного исследования и показали преимущество гемцитабина над 5-фторурацилом с точки зрения общей выживаемости и контроля болевого синдрома [7].
До недавнего времени все попытки улучшить результаты лечения за счет создания комбинаций гемцитабина с цитотоксическими или таргетными препаратами являлись безрезультатными 16.
Однако с 2011 г. начали появляться публикации, показавшие значимый прогресс в увеличении выживаемости пациентов с метастатическим РПЖ при применении режима FOLFIRINOX [18] и nab-паклитаксела с гемцитабином [19]. Основным лимитирующим фактором применения комбинированных режимов химиотерапии является их токсичность, что требует индивидуальной оценки клинических и лабораторных показателей пациента для выбора наиболее эффективной и безопасной тактики лечения.
Режим FOLFIRINOX
В 2011 г. были опубликованы результаты многоцентрового исследования II/III фазы PRODIGE 4/ACCORD 11.
Nab-паклитаксел представляет собой комплекс молекул альбумина диаметром 130 нм, с каждой из которых связано 6-7 молекул паклитаксела. Данная структура существенно меняет фармакокинетику паклитаксела, которая в случае nab-паклитаксела определяется фармакокинетикой альбумина. В итоге в опухолевой ткани и цитоплазме опухолевых клеток достигается большая концентрация препарата.
Положительные результаты лабораторных экспериментов и клинического исследования I/II фазы привели к инициации крупного рандомизированного исследования III фазы MPACT, включившего 861 пациента с метастатическим РПЖ [19]
Режим: Nab- Паклитакел 100-125 мг/м2 + Гемцитабин 750-1000 мг/м2 1, 8, 15 дни 28-дневного цикла.
Статистически значимое улучшение общей выживаемости было продемонстрировано в группе комбинированного лечения и составило 8, 7 против 6, 6 месяца в группе гемцитабина. Трехлетнего рубежа достигли 4% пациентов из группы комбинированного лечения и ни один из пациентов контрольной группы [19]. Исследование МРАСТ продемонстрировало значительное увеличение частоты объективных эффектов: с 7% в группе монотерапии до 23% в группе комбинированного лечения [19]
GEMCAP
Еще одна схема комбинированной химиотерапии не продемонстрировала выдающихся результатов при лечении распространенного заболевания, но значительно улучшила выживаемость при использовании в адьювантном режиме.
24 января 2017 года в журнале The Lancet были опубликованы результаты открытого многоцентрового рандомизированного исследования III фазы ESPAC-4, посвященного сравнению эффективности применения комбинации гемцитабина и капецитабина (GemCap) и монотерапии гемцитабином в адъювантной терапии РПЖ. Результаты исследования продемонстрировали, что применение комбинированной адъювантной терапии позволяет удвоить 5-летнюю ОВ подгруппе пациентов с R0 [20].
В исследование включались больные, прошедшие хирургическое лечение, у которых была достигнута R0 (отсутствие опухолевых клеток по краю резекции) или R1 (наличие опухолевых клеток в крае резекции, но отсутствие макроскопической опухоли) резекция РПЖ.
Всего в исследование было включено 730 пациентов, которые были рандомизированы в соотношении 1: 1 в следующие группы:
По результатам исследования медиана общей выживаемости (ОВ) пациентов составила 28, 0 мес. в группе терапии гемцитабином в комбинации с капецитабином по сравнению с 25, 5 мес. в группе монотерапии гемцитабином (отношение рисков [ОР] 0, 82; p = 0, 032). Показатель медианы ВБП составил 13, 9 мес. и 13, 1 мес. (ОР 0, 86; p = 0, 082) соответственно, показатель ВБП в течение 5 лет – 20, 9% и 11, 9%. [20].
Описание случая.
Больной С., 59 лет, обратился в Клиническую больницу № 1 УДП РФ
21. 03. 17 с жалобами на опоясывающие боли в эпигастрии с иррадиацией в поясницу, похудание более 10 кг за 3 месяца.
Из анамнеза: с 2016г пациента беспокоили боли в животе, постепенно усиливавшиеся по интенсивности и приобретавшие опоясывающий характер, снижение массы тела, к врачу не обращался.
Установлен диагноз: рак поджелудочной железы T3N1M1, IV стадия, канцероматоз брюшины.
В послеоперационном периоде длительно находился в реанимационном отделении, так как нуждался в перидуральной анестезии с использованием наркотиченских анальгетиков в связи с выраженным болевым синдромом.
Обсужден на онкоконсилиуме, в связи с ослабленным состоянием ( ECOG3) рекомендовано проведение химиотерапии по схеме: Гемцитабином 1000 мг/м2 1, 8, 15 дни с интервалом в 3 недели, Капецитабином 2000мг/м2 в сутки 1-14 дни каждые 28 дней.
Динамика онкомаркеров на фоне лечения:
СА 19. 9 22. 03. 17 3618 РЭА 2. 82
23. 11. 17 197. 8 РЭА 3. 6
Производились также контрольные КТ органов брюшной полости с внутривенным контрастированием 10. 05. 17 – заключение: опухолевое образование без динамики, 12. 07. 17 – без динамики и 13. 09. 17 – слабоположительная динамика. При КТ грудной клетки 12. 09. 17 – без опухолевой патологии.
Учитывая отсутствие дальнейшей положительной динамики последние 3 курса и усталость пациента от лечения, решено химиотерапию прекратить, продолжить динамическое наблюдение.
После 7. 01. 18 отметил появление болей в эпигастрии, незначительных по силе. Онкомаркеры от 15. 01. 18: СА 19. 9 666. 2, РЭА 3. 71
КТ грудной клетки 16. 01. 18 – отсутствие метастазов. КТ брюшной полости с контрастом 15. 01. 18 – отрицательная динамика.
Динамика онкомаркеров на фоне лечения:
СА 19. 9 29. 01. 18 1254
17. 07. 18 219. 3 РЭА 6. 94
31. 07. 18 226. 3 6. 97
14. 08. 18 159. 3 7. 2
КТ ОГК 10. 04. 18 – без опухолевой патологии.
КТ ОБП с контрастом 14. 08. 18 – без существенной динамики.
Пациент к началу очередного курса функционально не восстанавливается, астеничен. Сохраняется гепатотоксичность и нейтропения.
В связи с отсутствием объективного эффекта, стойкой стабилизацией и токсичностью решено воздержаться от проведения очередного цикла полихимиотерапии. Контроль показателей крови и онкомаркеров раз в 3-4 недели на фоне симптоматической терапии.
Длительное время пациент удовлетворительно себя чувствовал, работал и не нуждался в сопроводительной терапии.
ПЭТ КТ от 18. 10. 18: Состояние после наложения гастроэнтероанастомоза (03. 2017) узловое образование по стенке луковицы 12 перстной кишки с повышенной фиксацией РФП специфического характера, очаговое образование на брыжейке специфического характера без метаболической активности ФДГ. В поджелудочной железе очагов повышенной фиксации РФП не выявлено. РЭА 3. 94, СА 19. 9 912.
В 12. 2018 болевой синдром значительно усилился, СА 19. 9 1250, при сцинтиграфии костей нельзя исключить вторичного поражения. В паллиативной лучевой терапии пациенту было отказано. В это же время вновь появились боли в эпигастрии. Планировалась 3 линия химиотерапии с включением Наб- Паклитаксела, однако пациент решил воздержаться от специального лечения и в дальнейшем получал только симптоматическую терапию
Смерть пациента наступила 04. 07. 19.
Таким образом, на фоне химиотерапии и симптоматического лечения пациент изначально с IV стадией рака поджелудочной железы, ECOG 3 и выраженным болевым синдромом, требовавшим спинальной анальгезии, прожил 27 месяцев.
ЗАКЛЮЧЕНИЕ
Из представленного клинического случая можно сделать некоторые выводы:
1. У больных относительно молодого возраста, при отсутствии выраженной сопутствующей патологии, несмотря на наличие неоперабельной опухоли и значительную распространенность заболевания обязательно нужно предпринимать попытку полихимиотерапии
2. Даже при отсутствии объективного эффекта в ряде случаев удается добиться длительной стабилизации при удовлетворительном общем состоянии пациента а также увеличения продолжительности жизни ( ECOG 0-1)
3. В случае корелляции между клиническим эффектом и уровнем онкомаркеров, они могут использоваться для оценки динамики процесса.
4. Схемы GEMCAP и FOLFIRINOX обладают достаточной активностью для эффективного контроля заболевания.
Список литературы
1. А. С. ПОПОВА, И. А. ПОКАТАЕВ, С. А. ТЮЛЯНДИН. Комбинированные режимы химиотерапии при раке поджелудочной железы. 10. 21518/2079-701X-2017-6-62-70
2. Состояние онкологической помощи населению России в 2018 году под редакцией А. Д. КАПРИНА, В. В. СТАРИНСКОГО, Г. В. ПЕТРОВОЙ, Москва 2019
3. SEER Stat Fact Sheets: Pancreas Cancer, 2015 // URL: http//seer. cancer. gov/statfacts/htmL/ pancreas. html
4. GLimeLius B et aL. Chemotherapy improves survival and quaLity of Life in advanced pancreatic and biLiary cancer. Annals of Oncology, 1996, 7 (6): 593-600.
5. Raderer M et aL. Treatment of advanced pancreatic cancer with epirubicin, 5-fLuorouraciL and L-Leucovorin: A phase II study. Annals of oncology, 1997, 8 (8): 797-799.
6. Bruckner HW et aL. Phase II triaL of combination chemotherapy for pancreatic cancer with 5-fLuorouraciL, mitomycin C, and hexamethyL- meLamine. Oncology, 1983, 40 (3): 165-169
7. Burris 3rd HA et aL. Improvements in survival and cLinicaL benefit with gemcitabine as first- Line therapy for patients with advanced pancreas cancer: a randomized triaL. Journal of Clinical Oncology, 1997, 15 (6): 2403-2413.
8. BerLin JD et aL. Phase III study of gemcitabine in combination with fLuorouraciL versus gem- citabine aLone in patients with advanced pan¬creatic carcinoma: Eastern Cooperative OncoLogy Group TriaL E2297. Journal of Clinical Oncology 2002, 20 (15): 3270-3275.
9. Rocha Lima CM et aL. Irinotecan pLus gemcitabine resuLts in no survivaL advantage compared with gemcitabine monotherapy in patients with LocaL¬Ly advanced or metastatic pancreatic cancer despite increased tumor response rate. Journal of Clinical Oncology, 2004, 22 (18): 3776-3783.
10. Louvet C et aL. Gemcitabine in combination with oxaLipLatin compared with gemcitabine aLone in LocaLLy advanced or metastatic pan¬creatic cancer: resuLts of a GERCOR and GISCAD phase III triaL. Journal of Clinical Oncology, 2005, 23 (15): 3509-3516.
11. Heinemann V et aL. Randomized phase III triaL of gemcitabine pLus cispLatin compared with gemcitabine aLone in advanced pancreatic can¬cer. Journal of Clinical Oncology, 2006, 24 (24): 3946-3952.
12. Herrmann R et aL. Gemcitabine pLus capecitabine compared with gemcitabine aLone in advanced pancreatic cancer: a randomized, muLticenter, phase III triaL of the Swiss Group for CLinicaL Cancer Research and the CentraL European Cooperative OncoLogy Group. Journal of Clinical Oncology, 2007, 25 (16): 2212-2217.
13. Cunningham D et aL. Phase III randomized comparison of gemcitabine versus gemcitabine pLus capecitabine in patients with advanced pancreatic cancer. Journal of Clinical Oncology, 2009 27 (33): 5513-5518.
14. PhiLip PA et aL. Phase III study comparing gem- citabine pLus cetuximab versus gemcitabine in patients with advanced pancreatic adenocarci¬noma: Southwest OncoLogy Group-directed intergroup triaL S0205. Journal of Clinical Oncology, 2010, 28 (22): 3605-3610.
15. Van Cutsem E et aL. Phase III triaL of bevacizumab in combination with gemcitabine and erLotinib in patients with metastatic pancreatic cancer. Journal of Clinical Oncology, 2009,
16. Gonsalves A et al. BAYPAN study: a double-blind phase III randomized trial comparing gemcitabine plus sorafenib and gemcitabine plus placebo in patients with advanced pancreatic cancer. Annals of oncology, 2012, 23 (11): 2799-2805.
17. Rougier P et al. Randomised, placebo-controlled, double-blind, parallel-group phase III study evaluating aflibercept in patients receiving first-line treatment with gemcitabine for metastatic pancreatic cancer. European journal of cancer, 2013, 49 (12): 2633-2642
18. Conroy T et al. FOLFIRINOX versus gemcitabine for metastatic pancreatic cancer. New England Journal of Medicine, 2011, 364 (19): 1817-1825.
19. Von Hoff DD et al. Increased survival in pan¬creatic cancer with nab-paclitaxel plus gemcit¬abine. New
20. Neoptolemos JP, Palmer DH, Graneh P et al. Comparison of adjuvant gemcitabine and capecitabine with gemcitabine monotherapy in patients with resected pancreatic cancer (ESPAC-4): a multicentre, open-label, randomised, phase 3 trial. The Lancet [Published online January 24, 2017].
