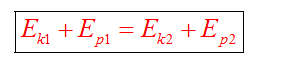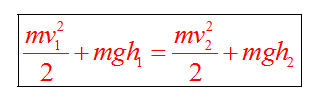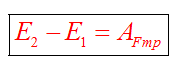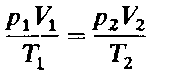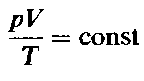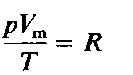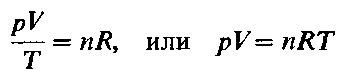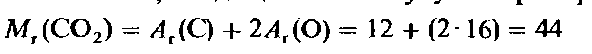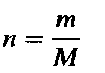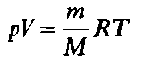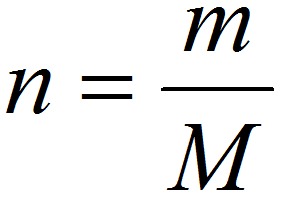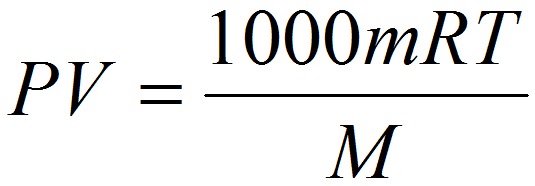Что относится к химии примеры
Химические вещества: примеры, свойства
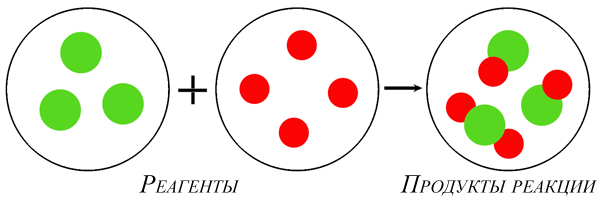
Элементарными частицами физической материи на нашей планете являются атомы. В свободном виде они могут существовать только при очень высоких температурах. В обычных условиях элементарные частицы стремятся к объединению между собой при помощи химических связей: ионной, металлической, ковалентной полярной или неполярной. Таким способом образуются вещества, примеры которых мы и рассмотрим в нашей статье.
Простые вещества
Процессы взаимодействия между собой атомов одного и того же химического элемента заканчиваются образованием химических веществ, называемых простыми. Так, уголь образован только атомами углерода, газ водород – атомами гидрогена, а жидкая ртуть состоит из частиц ртути. Понятие простое вещество не нужно отождествлять с понятием химического элемента. Например, углекислый газ состоит не из простых веществ углерода и кислорода, а из элементов карбона и оксигена. Условно соединения, состоящие из атомов одного и того же элемента, можно разделить на металлы и неметаллы. Рассмотрим некоторые примеры химических свойств таких простых веществ.
Металлы
Исходя из положения металлического элемента в периодической системе, можно выделить следующие группы: активные металлы, элементы главных подгрупп третьей – восьмой групп, металлы побочных подгрупп четвертой – седьмой групп, а также лантаноиды и актиноиды. Металлы – простые вещества, примеры которых мы приведем далее, имеют следующие общие свойства: тепло- и электропроводность, металлический блеск, пластичность и ковкость. Такие характеристики присущи железу, алюминию, меди и другим. С увеличением порядкового номера в периодах возрастают температуры кипения, плавления, а также твердость металлических элементов. Это объясняется сжатием их атомов, то есть уменьшением радиуса, а также накоплением электронов. Все параметры металлов обусловлены внутренним строением кристаллической решетки данных соединений. Ниже рассмотрим химические реакции, а также приведем примеры свойств веществ, относящихся к металлам.
Особенности химических реакций
Все металлы, имеющие степень окисления 0, проявляют только свойства восстановителей. Щелочные и щелочноземельные элементы взаимодействуют с водой с образованием химически агрессивных оснований – щелочей:
Типичная реакция металлов – окисление. В результате соединения с атомами кислорода, возникают вещества класса оксидов:
Это бинарные соединения, относящиеся к сложным веществам. Примерами основных окислов являются оксиды натрия Na2O, меди CuO, кальция CaO. Они способны ко взаимодействию с кислотами, в результате в продуктах обнаруживается соль и вода:
Вещества классов кислот, оснований, солей относятся к сложным соединениям и проявляют разнообразные химические свойства. Например, между гидроксидами и кислотами происходит реакция нейтрализации, приводящая к появлению соли и воды. Состав солей будет зависеть от концентрации реагентов: так, при избытке в реагирующей смеси кислоты, получаются кислые соли, например, NaHCO3 – гидрокарбонат натрия, а высокая концентрация щелочи вызывает образование основных солей, таких как Al(OH)2Cl – дигидроксохлорид алюминия.
Неметаллы
Наиболее важные неметаллические элементы находятся в подгруппах азота, карбона, а также относятся к группам галогенов и халькогенов периодической системы. Приведем примеры веществ, относящихся к неметаллам: это сера, кислород, азот, хлор. Все их физические особенности противоположны свойствам металлов. Они не проводят электрический ток, плохо пропускают тепловые лучи, имеют низкую твердость. Взаимодействуя с кислородом, неметаллы образуют сложные соединения – кислотные оксиды. Последние, реагируя с кислотами, дают кислоты:
Типичная реакция, характерная для кислотных окислов – это взаимодействие со щелочами, приводящее к появлению соли и воды.
Химическая активность неметаллов в периоде усиливается, это связано с увеличением способности их атомов притягивать электроны от других химических элементов. В группах наблюдаем обратное явление: неметаллические свойства ослабевают вследствие раздувания объема атома за счет добавления новых энергетических уровней.
Итак, мы рассмотрели виды химических веществ, примеры, иллюстрирующие их свойства, положение в периодической системе.
Классификация веществ
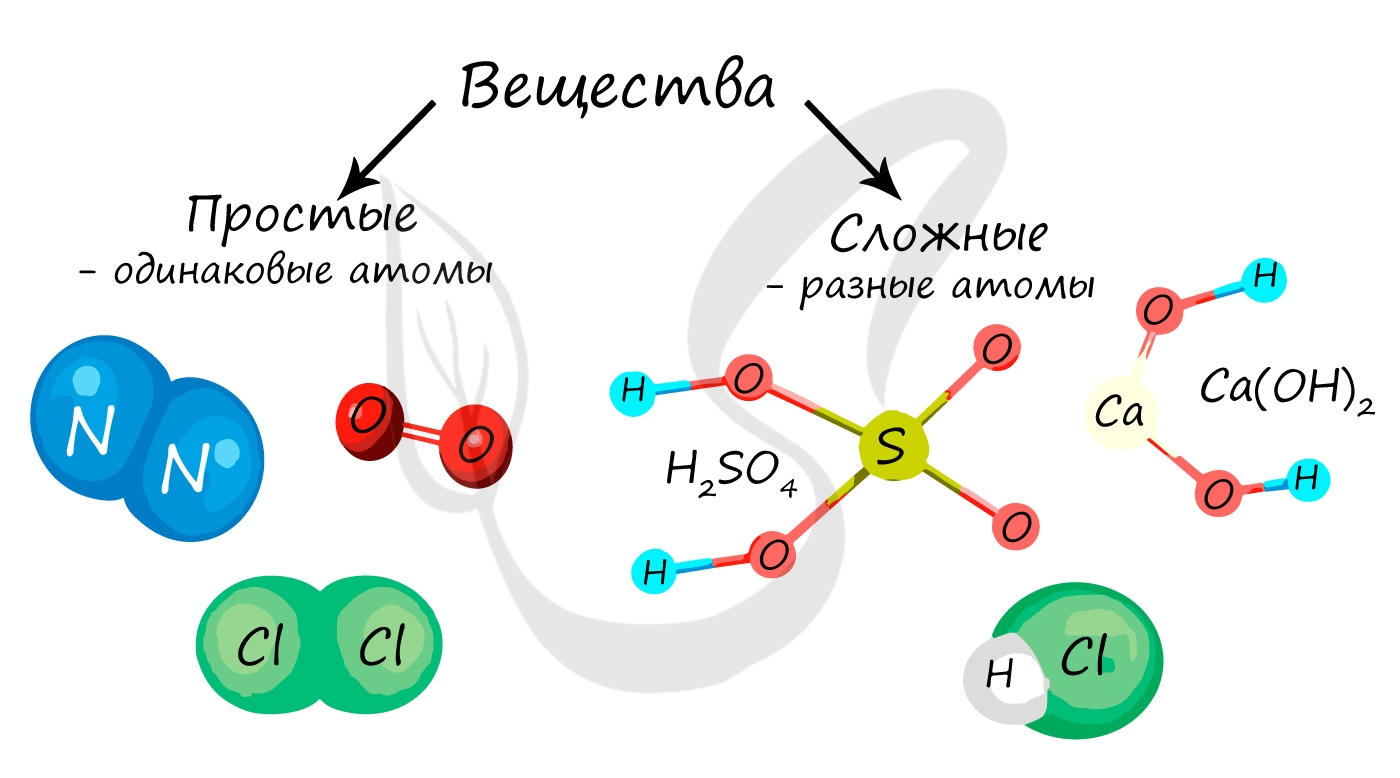
Простые и сложные вещества
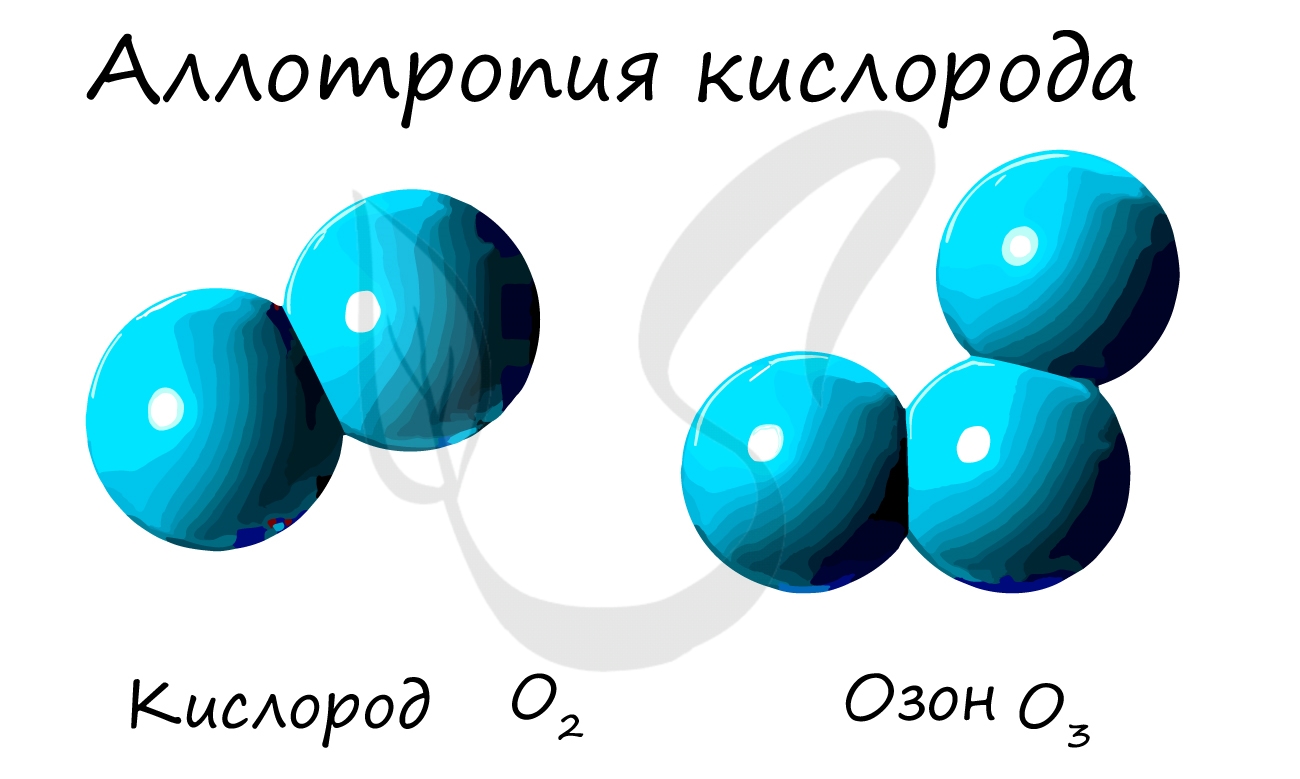
Простые вещества состоят из атомов одного химического элемента, то есть их образуют два и более одинаковых атома: H2, N2, O2, O3(озон), Mn, Fe.
Сложные вещества состоят из атомов двух и более видов: KMnO4, H2SO4, HCl.
Хочу заметить важную деталь: необходимо четко разделять химические и физические реакции. При химических реакциях происходят изменения в составе молекул: одни атомы сменяются другими, молекулы рвутся на части и собираются снова в обновленном виде.
При физических реакциях молекулы неизменны, связи атомов внутри них не подвергается изменениям.
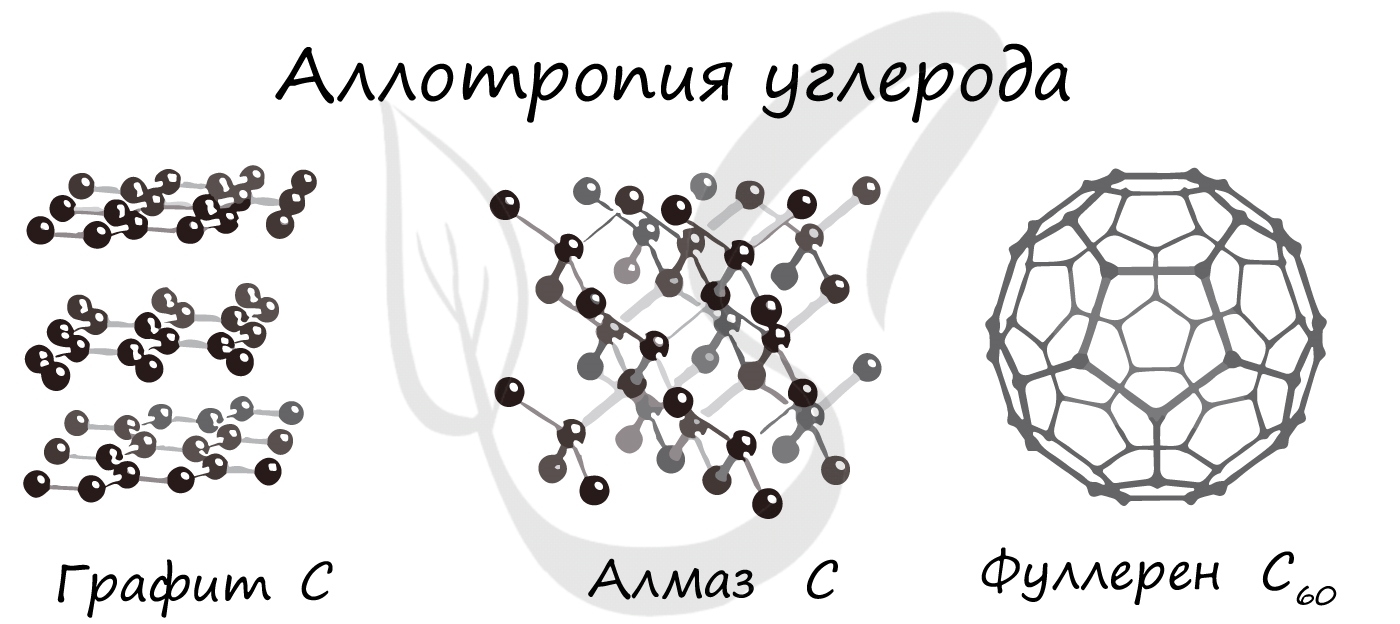
Аллотропия
Аллотропные модификации серы включают ромбическую, моноклинную, и пластическую серу. Ромбическая (S8) и моноклинная сера (S8) имеют молекулярное строение. Пластическая сера (S∞) представляет собой длинные цепочки атомов, тем не менее также характеризуется молекулярным строением.
Надо заметить, что с течением времени, пластическая и моноклинная модификации серы, неустойчивые, превращаются в ромбическую, наиболее устойчивую.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
20 видов химии и ее значение
виды химии можно классифицировать на органическую, неорганическую, биохимическую, физико-химическую, аналитическую химию, астрохимию, электрохимию, фотохимию, геохимию, нанохимию, нейрохимию, промышленную химию, фармацевтическую химию, нефтехимию, ядерную химию, химию окружающей среды, квантовую химию, теоретическую химию, вычислительную химию и магнитохимия.
Химия определяется как наука, которая отвечает за изучение материи и изменений, которые она претерпевает. В частности, он изучает как структуру вещества, его состав и его свойства. Он также изучает энергетические и внутренние изменения, которые претерпевает материя. Он считается одной из основных наук, но не из-за своей простоты, а скорее из-за его важности.
Это базовая дисциплина, потому что на нее поддерживаются целые, такие как медицина, биология, фармакология, металлургия и даже экология. И поскольку существует бесчисленное множество типов материалов, химию подразделяют на несколько типов. Это означает, что для каждого изучаемого материала существует тип химии.
Органическая химия
Можно сказать, что это тот вид химии, который изучает саму жизнь. И что эта ветвь отвечает за изучение соединений, которые содержат атомы углерода / водорода, а также их различные реакции.
Вещества, образованные органическими молекулами, многочисленны и варьируются от лекарств и витаминов до пластмасс, синтетических и натуральных волокон, углеводов, белков и жиров..
Неорганическая химия
В отличие от органической химии, неорганический относится к тем элементам, которые не имеют собственной жизни. Поэтому он отвечает за изучение соединений и реакций материалов, которые не содержат атомов углерода / водорода..
В данном случае речь идет о минералах, металлах или керамических материалах. Этот тип химии имеет другие применения, такие как волоконно-оптические, бетонные или электронные чипы.
биохимия
Это тип химии, который отвечает за изучение химической основы молекул. Более конкретно, это изучение химического состава и свойств живых существ (белков, углеводов, липидов, реакций в клетках и нуклеиновых кислот).
Физическая химия
В этом типе химии используются различные методы физики для изучения структуры и свойств вещества. В этом подразделе предмет изучается на основе физических принципов, регулирующих поведение атомов, молекул и других химических систем..
Аналитическая химия
Этот тип химии посвящен изучению различных соединений природы, в чистом виде или в виде комбинированных веществ..
Аналитическая химия основана на идентификации и количественном определении материалов в смеси или в конкретных химических соединениях. Эта отрасль в свою очередь делится на качественную аналитическую химию и количественную аналитическую химию.
астрохимия
Эта ветвь изучает химический состав небесных тел, таких как звезды, планеты, кометы, а также материал межзвездного пространства..
Астрохимики применяют методы радиоастрономии и спектроскопии для проведения различных анализов межзвездного вещества, галактик и звезд.
электрохимия
Этот субдисциплина отвечает за изучение реакций, которые производят электрические эффекты, в связи с химическими реакциями. То есть речь идет о корреляции между этими химическими реакциями и превращениями химической энергии в электрическую и наоборот..
фотохимия
Этот тип химии отвечает за анализ как явлений, так и взаимосвязей между молекулами и атомами, а также их взаимосвязи со светом и электромагнитным излучением..
В этой категории также есть различные применения, такие как создание веществ, которые производят поглощение определенных электромагнитных длин волн. Чтобы произошло фотохимическое явление, необходимо получить световую энергию и химическую реакцию.
геохимия
Это специальность отраслей природы, которая отвечает за изучение химических свойств различных минералов Земли. Он основан на геологии и химии для изучения структуры и активов химических компонентов, которые существуют на Земле..
нанохимия
В эту категорию входят все те виды деятельности, которые связаны с нанонаукой и нанотехнологиями. Эти области имеют общее использование традиционных инструментов химии для создания, развития и исследования объектов, которые имеют наноскопические размеры.
Эта дисциплина отвечает за изучение уникальных характеристик наборов молекул или атомов, применяемых в возможных областях, таких как медицина..
нейрохимия
Это в основном химия функционирования мозга. Именно эта отрасль основана на изучении взаимодействия химических веществ в мозге, таких как серотонин, мелатонин, гормоны и нейротрансмиттеры, а также психотропные препараты и другие вещества, и их влияние на мозг.
Промышленная химия
В этой отрасли химические знания применяются для производства материалов и химических продуктов с минимальным воздействием на окружающую среду. В этой области изучаются процессы, используемые в промышленном секторе для преобразования материи..
В промышленной химии участвуют четыре процесса: передача тепла, передача импульса, передача вещества и химическое изменение..
Фармацевтическая химия
Этот тип химии отвечает как за исследования, так и за производство лекарств для борьбы с медико-психиатрическими состояниями. Эта подкатегория принадлежит еще двум категориям: прикладная химия и промышленная.
В основном это включает изучение, анализ, поиск и настройку органических и неорганических соединений, в данном случае для использования в области медицины..
нефтехимия
Это подразделение двух типов химии: органической и промышленной. Это наука, которая отвечает за изучение и превращение веществ из углеводородов, таких как нефть и природный газ, для превращения их в топливо и другие полезные для человека химические вещества, такие как пластик и полимеры..
Этот тип химии также посвящен предоставлению знаний и механизмов для извлечения химических веществ из ископаемого топлива. С другой стороны, эта отрасль также позволяет производить такие продукты, как пестициды, гербициды и удобрения, а также производство асфальта и синтетических волокон..
Ядерная химия
Эта ветвь химии изучает модификации, которые происходят в ядре атома, естественным или искусственным путем. Но также он отвечает за анализ химических реакций радиоактивных веществ, таких как радон, уран, радий и актиниды.
Для применения ядерной химии необходимо использование специального оборудования, как в случае известных ядерных реакторов. Именно благодаря этому типу химии стало возможным использовать ядерную энергию в мире, несмотря на опасности и стигму, вызванные различными трагедиями, которые произошли..
Экологическая химия
Это подкатегория, которая изучает влияние и воздействие химических компонентов на окружающую среду. Это исследование включает как химические вещества, обнаруженные в самой природе, так и влияние химических продуктов, выбрасываемых в окружающую среду..
Квантовая химия
В этой области квантовая механика и теория поля используются в химических задачах. Эта химия носит теоретический характер и описывает поведение материи с использованием математики..
Одним из приложений квантовой химии является интегральное исследование атомов и молекул, то есть, в отношении их поведения, их свойств, их химической реактивности, среди других аспектов.
Теоретическая химия
В этой отрасли физика используется для объяснения или предсказания различных химических явлений. Теоретическая химия состоит в основном в использовании квантовой химии, точнее, в применении квантовой механики к химическим проблемам.
Вычислительная химия
В этой отрасли существующие программы и методы в компьютерном мире используются для решения химических проблем. В этом случае результаты теоретической химии включаются в программное обеспечение для расчета структур и свойств молекул и твердых тел..
магнитохимией
Этот тип химии отвечает как за синтез, так и за исследование магнитных свойств веществ. Исследования в этой области основаны на поиске новых материалов, которые имеют важные магнитные свойства или которые объединяют магнитные и электрические или магнитные и оптические свойства.
Классификация неорганических веществ
Среди простых веществ выделяют металлы и неметаллы. Среди сложных: оксиды, основания, кислоты и соли. Классификация неорганических веществ построена следующим образом:
Большинство химических свойств мы изучим по мере продвижения по периодической таблице Д.И. Менделеева. В этой статье мне хотелось бы подчеркнуть ряд принципиальных деталей, которые помогут в дальнейшем при изучении химии.
Оксиды
Все оксиды подразделяются на солеобразующие и несолеобразующие. Солеобразующие имеют соответствующие им основания и кислоты (в той же степени окисления (СО)!) и охотно вступают в реакции солеобразования. К ним относятся, например:
Солеобразующие оксиды, в свою очередь, делятся на основные, амфотерные и кислотные.
Основным оксидам соответствуют основания в той же СО. В химических реакциях основные оксиды проявляют основные свойства, образуются исключительно металлами. Примеры: Li2O, Na2O, K2O, Rb2O CaO, FeO, CrO, MnO.
Основные оксиды взаимодействуют с водой с образованием соответствующего основания (реакцию идет, если основание растворимо) и с кислотными оксидами и кислотами с образованием солей. Между собой основные оксиды не взаимодействуют.
Li2O + H2O → LiOH (основный оксид + вода → основание)
Здесь не происходит окисления/восстановления, поэтому сохраняйте исходные степени окисления атомов.
Эти оксиды действительно имеют двойственный характер: они проявляют как кислотные, так и основные свойства. Примеры: BeO, ZnO, Al2O3, Fe2O3, Cr2O3, MnO2, PbO, PbO2, Ga2O3.
С водой они не взаимодействуют, так как продукт реакции, основание, получается нерастворимым. Амфотерные оксиды реагируют как с кислотами и кислотными оксидами, так и с основаниями и основными оксидами.
ZnO + KOH + H2O → K2[Zn(OH)4] (амф. оксид + основание = комплексная соль)
ZnO + N2O5 → Zn(NO3)2 (амф. оксид + кисл. оксид = соль; СО азота сохраняется в ходе реакции)
Fe2O3 + HCl → FeCl3 + H2O (амф. оксид + кислота = соль + вода; обратите внимание на то, что СО Fe = +3 не меняется в ходе реакции)
Проявляют в ходе химических реакций кислотные свойства. Образованы металлами и неметаллами, чаще всего в высокой СО. Примеры: SO2, SO3, P2O5, N2O3, NO2, N2O5, SiO2, MnO3, Mn2O7.
Кислотные оксиды вступают в реакцию с основными и амфотерными, реагируют с основаниями. Реакции между кислотными оксидами не характерны.
SO2 + Na2O → Na2SO3 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +4)
SO3 + Li2O → Li2SO4 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +6)
P2O5 + NaOH → Na3PO4 + H2O (кисл. оксид + основание = соль + вода)
Реакции несолеобразующих оксидов с основаниями, кислотами и солеобразующими оксидов редки и не приводят к образованию солей. Некоторые из несолеобразующих оксидов используют в качестве восстановителей:
FeO + CO → Fe + CO2 (восстановление железа из его оксида)
Основания
Основания классифицируются по количеству гидроксид-ионов в молекуле на одно-, двух- и трехкислотные.
Так же, как и оксиды, основания различаются по свойствам. Все основания хорошо реагируют с кислотами, даже нерастворимые основания способны растворяться в кислотах. Также нерастворимые основания при нагревании легко разлагаются на воду и соответствующий оксид.
Mg(OH)2 → (t) MgO + H2O (при нагревании нерастворимые основания легко разлагаются)
Если в ходе реакции основания с солью выделяется газ, выпадает осадок или образуется слабый электролит (вода), то такая реакция идет. Нерастворимые основания с солями почти не реагируют.
Ba(OH)2 + NH4Cl → BaCl2 + NH3 + H2O (в ходе реакции образуется нестойкое основание NH4OH, которое распадается на NH3 и H2O)
KOH + BaCl2 ↛ реакция не идет, так как в продуктах нет газа/осадка/слабого электролита (воды)
В растворах щелочей pH > 7, поэтому лакмус окрашивает их в синий цвет.
Al(OH)3 + HCl → AlCl3 + H2O (амф. гидроксид + кислота = соль + вода)
Al(OH)3 + KOH → K[Al(OH)4] (амф. гидроксид + основание = комплексная соль)
При нагревании до высоких температур комплексные соли не образуются.
Кислоты
Кислоты отлично реагируют с основными оксидами, основаниями, растворяя даже те, которые выпали в осадок (реакция нейтрализации). Также кислоты способны вступать в реакцию с теми металлами, которые стоят в ряду напряжений до водорода (то есть способны вытеснить его из кислоты).
Zn + HCl → ZnCl2 + H2↑ (реакция идет, так как цинк стоил в ряду активности левее водорода и способен вытеснить его из кислоты)
Cu + HCl ↛ (реакция не идет, так как медь расположена в ряду активности правее водорода, менее активна и не способна вытеснить его из кислоты)
Все кислоты подразделяются на сильные и слабые. Напомню, что мы составили подробную таблицу сильных и слабых кислот (и оснований!) в теме гидролиз. В реакции из сильной кислоты (соляной) можно получить более слабую, например, сероводородную или угольную кислоту.
В завершении подтемы кислот предлагаю вам вспомнить названия основных кислот и их кислотных остатков.
Блиц-опрос по теме Классификация неорганических веществ
Основные понятия химии
Атом — мельчайшая, химически неделимая, электронейтральная частица вещества. Состоит из ядра и электронной оболочки.
Вещество — вид материи с определёнными химическими и физическими свойствами. Совокупность атомов, атомных частиц или молекул, находящаяся в определённом агрегатном состоянии. Из веществ состоят физические тела (медь — вещество, а медная монета — физическое тело).
Валентность — количество химических связей, которое образует один атом.
Молекула — наименьшая частица вещества, сохраняющая его химические свойства. Состоит из атомов.
Свойства — совокупность признаков по которым одни вещества отличаются от других, они бывают химическими и физическими.
Физические свойства — признаки вещества, при характеристике которых вещество не изменяет свой химический состав (плотность, агрегатное состояние, температуры плавления и кипения и т. п.)
Химические свойства — способность веществ взаимодействовать с другими веществами или изменяться под действием определённых условий. Результатом является превращение одного вещества или веществ в другие вещества.
Агрегатные состояния а веществ— состояние вещества, характеризующееся определенными свойствами (способность сохранять форму, объем). Выделяют три основных агрегатных состояния: твёрдое тело, жидкость и газ. Иногда не совсем корректно к агрегатным состояниям причисляют плазмуw. Существуют и другие агрегатные состояния, например, жидкие кристаллыw или конденсат Бозе — Эйнштейнаw.
Моль — мера количества вещества, содержащая Число Авогадроw (NA ≈ 6,02 × 1023) любых структурных частиц. (NA — количество атомов в 12 граммах углерода 12Cw.)
Периодический закон — фундаментальный закон природы, открытый Д. И. Менделеевым в 1869 году при сопоставлении свойств известных в то время химических элементов и величин их атомных масс. В настоящее время Периодический закон Д. И. Менделеева имеет следующую формулировку: «свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов». Особенность Периодического закона среди других фундаментальных законов заключается в том, что он не имеет выражения в виде математического уравнения. Графическим (табличным) выражением закона является Периодическая система химических элементовw, первоначальный вариант которой был разработан Д. И. Менделеевым в 1869—1871 годах.
Простое вещество — вещество, состоящее из атомов одного химического элемента: водород, кислород и т. д.
Сложное вещество — вещество, состоящее из атомов разных химических элементов: кислоты, вода и др.
Относительная атомная масса — масса (а. е. м.) 6,02 × 1023 молекул простого вещества, где а. е. м. — атомная единица массыw.
Относительная молекулярная масса — масса (а. е. м.) 6,02 × 1023 молекул сложного вещества. Численно равна молярной массе, но отличается размерностью.
Химическая связь — это взаимодействие атомов, обуславливающее устойчивость молекулы или кристаллаw как целого. Химическая связь определяется взаимодействием между заряженными частицамиw (ядрамиw и электронамиw).
Полимеры — высокомолекулярные соединения, молекулы которых состоят из повторяющихся фрагментов (структурных звеньев).
Степень полимеризации — число структурных звеньев, входящих в состав макромолекулы.
Гомополимеры — полимеры, образованные из одинаковых по составу и строению мономеровw.
Мономер — низкомолекулярное вещество, образующее полимер в реакции полимеризацииw.
Сополимеры — полимеры, образованные из двух и более мономеров.
Сополимеризация — реакция полимеризации с участием двух или более различных мономеров.
Электрохимия — раздел химической науки, в котором рассматриваются системы и межфазные границы при протекании через них электрического тока, исследуются процессы в проводниках, на электродах (из металлов или полупроводников, включая графит) и в ионных проводниках (электролитах). Электрохимия исследует процессы окисления и восстановления, протекающие на пространственно-разделённых электродах, перенос ионов и электронов.
Электродный потенциал — разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом.
Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении.
Электролит — вещество, которое проводит электрический ток вследствие диссоциации на ионы, что происходит в растворах и расплавах, или движения ионов в кристаллических решётках твёрдых электролитов.
Электролиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор, либо расплав электролита.
Гомологический ряд — ряд химических соединений одного структурного типа (например, алканы или алифатические спирты — спирты жирного ряда), отличающихся друг от друга по составу на определенное число повторяющихся структурных единиц — так называемую «гомологическую разность».
Изомерия — явление, заключающееся в существовании химических соединений (изомеров), одинаковых по составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и, вследствие этого, по свойствам.
Изомеры — соединения, обладающие одинаковым элементарным составом, но различным химическим строением.
Химическое равновесие — это такое состояние системы, когда скорость прямой реакции равна скорости обратной реакции.
Тепловой эффект реакции — это теплота, которая выделяется или поглощается системой при течении в ней химической реакции. В зависимости от того, происходит реакция с выделением теплоты или сопровождается поглощением теплоты, различают экзо-и эндотермические реакции. К первым, как правило, относятся все реакции соединения, а ко вторым — реакции разложения.[1]
Катализатор — это вещество, которое изменяет скорость химической реакции, но количественно при этом не расходуется и в состав продуктов не входит.
Скорость химической реакции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства.
Термохимия — раздел химической термодинамики, в задачу которой входит определение и изучение тепловых эффектов реакций, а также установление их взаимосвязей с различными физико-химическими параметрами. Ещё одной из задач термохимии является измерение теплоёмкостей веществ и установление их теплот фазовых переходов.
Теплота — количественная мера хаотичного движения частиц данной системы, при этом не происходит переноса вещества от одной системы к другой.
Тепловой эффект — выделение или поглощение тепловой энергии системой при протекании в ней химической реакции, при условии, что система не совершает никакой другой работы кроме работы расширения.
Внутренняя энергия системы — суммарная энергия внутренней системы, включающая энергию взаимодействия и движения молекул, атомов, ядер, электронов в атомах, внутриядерную и другие виды энергии, кроме кинетической и потенциальной энергии системы, как целого.
Энтальпия — это энергия расширенной системы (термодинамическая функция, характеризующая систему, находящуюся при постоянном давлении).
Стандартная энтальпия (теплота) образования сложного вещества — тепловой эффект реакции образования 1 моля этого вещества из простых веществ, находящихся в устойчивом агрегатном состоянии при стандартных условиях (= 298 К и давлении 101 кПа).
Гомогенная система — однородная система, химический состав и физические свойства которой во всех частях одинаковы или меняются непрерывно, без скачков (между частями системы нет поверхностей раздела). В гомогенной системе из двух и более химических компонентов каждый компонент распределен в массе другого в виде молекул, атомов, ионов. Составные части гомогенной системы нельзя отделить друг от друга механическим путем.
Гетерогенная система — неоднородная система, состоящая из однородных частей (фаз), разделённых поверхностью раздела. Однородные части (фазы) могут отличаться друг от друга по составу и свойствам.
Скорость гомогенной реакции — количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени в единице объема системы.
Скорость гетерогенной реакции — количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени на единице площади поверхности фазы.[
Термодинамика — раздел науки, изучающий соотношения и превращения теплоты и других форм энергии. Термодинамика — это феноменологическая наука, опирающаяся на обобщения опытных фактов. Она изучает макроскопические системы, состоящие из огромного числа частиц — термодинамические системы.
Термодинамическая система — некая физическая система, состоящая из большого количества частиц, способная обмениваться с окружающей средой энергией и веществом. Также обычно полагается, что такая система подчиняется статистическим закономерностям.
Первый закон термодинамики — для изолированной системы (для которой исключен любой материальный или энергетический обмен с окружающей средой) внутренняя энергия постоянна.
Химический элемент — это вид атомов, характеризующийся определенными зарядами ядер и строением электронных оболочек. В настоящее время известно 110 элементов: 89 из них найдены в природе (на Земле), остальные получены искусственным путем. Атомы существуют в свободном состоянии, в соединениях с атомами того же или других элементов, образуя молекулы. Способность атомов вступать во взаимодействие с другими атомами и образовывать химические соединения определяется его строением. Атомы состоят из положительно заряженного ядра и отрицательно заряженных электронов, движущихся вокруг него, образуя электронейтральную систему, которая подчиняется законам, характерным для микросистем
Химическим эквивалентом вещества называется такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях. Масса 1 эквивалента вещества называется эквивалентной массой (mэкв).
Эквивалентную массу соединения можно определить по его химической формуле, например,
m экв(оксида) = М (оксида)/(число атомов кислорода*2);
m экв(основания) = М (основания)/число гидроксильных групп;
m экв(кислоты) = М кислоты/число протонов;
m экв(соли) = М соли /(число атомов металла*валентность металла).
Аналогично можно дать определение понятию эквивалентный объем.
Эквивалентный объем – это тот объем, который при данных условиях занимает 1 эквивалент вещества. Так как эквивалент водорода равен 1 моль, а в 22,4 л Н2 содержатся 2 эквивалента водорода; тогда эквивалентный объем водорода равен 22,4/2=11,2 л/моль, для О2 эквивалентный объем равен 5,6 л/моль.
Определить эквивалент вещества можно также по его соединению с другим веществом, эквивалент которого известен.
Определить молярную массу эквивалента (эквивалентную массу) можно исходя из закона эквивалентов, который гласит, что химические элементы соединяются между собой или замещают друг друга в количествах, пропорциональных их молярным массам эквивалентов:
m1/m2=Мэкв1/ Мэкв2, где
где m1 и m2 — массы реагирующих или образующихся веществ, m экв1 и m экв2 — эквивалентные массы этих веществ.
Основные законы химии
Закон сохранения массы веществ
Закон сохранения массы теоретически был описан в 1748 году, а экспериментально подтверждён в 1756 году русским ученым М.В. Ломоносовым. Ломоносов определил, что если сосуд с металлом взвесить до и после нагревания, не вскрывая его, то масса останется неизменной.
В 1789 году французский учёный Антуан Лавуазье подтвердил выводы Ломоносова.
Закон сохранения массы веществ формулируется так:
Масса веществ, вступивших в реакцию, равна массе продуктов реакции.
Атомно-молекулярное учение объясняет этот закон так: при химической реакции общее количество участвующих атомов не изменяется, а происходит лишь их перегруппировка. Так как число атомов до и после реакции не изменяется, то их общая масса тоже не изменяется.
Модель химической реакции
На основе закона сохранения массы веществ проводят количественный химический анализ.
Приведём пример. Составим химическое уравнение реакции разложения воды:
Число атомов кислорода слева от стрелки, т.е. до реакции, меньше в два раза, чем справа, т.е. после реакции. Для уравнивания количества веществ до и после реакции, нужно поставить коэффициент 2 перед формулой воды в левой части уравнения:
Закон постоянства состава
Закон постоянства состава впервые сформулировал в 1808г. французский учёный-химик Жозеф Луи Пруст.
Закон постоянства состава формулируется так:
Вещество, независимо от способа его получения, всегда имеет постоянный качественный и количественный состав.
Вещества с постоянным составом названы дальтонидами в честь английского химика Джона Дальтона.
Состав дальтонидов описывается химическими формулами с целыми стехиометрическими коэффициентами, например Н2О, НCl, СН4, СO2, С2Н5ОН.
Из закона постоянства состава следует, что при образовании сложного вещества элементы простых веществ соединяются друг с другом в строго определенных массовых долях.
Массовая доля элемента ωЭ показывает, какую часть составляет масса данного элемента от массы всего вещества, где
n – число атомов;
ArЭ – относительная атомная масса элемента;
Mr – относительная молекулярная масса вещества.
Развитие химии показало, что наряду с веществами, имеющими постоянный состав, существуют вещества с переменным составом, который зависит от способа получения. Такие вещества назвали в честь французского химика Клода Бертолле – бертоллидами.
Бертоллиды не подчиняются законам стехиометрии. Примеры бертоллидов есть в классах оксидов, сульфидов, карбидов, гидридов и пр.
Исходя из вышеизложенного, уточним формулировку закона постоянства состава:
Состав соединений с молекулярной структурой является постоянным независимо от способа получения. Состав же соединений с немолекулярной структурой (с атомной, ионной и металлической решеткой) не является постоянным и зависит от условий получения.
Периодический закон
Периодический закон сформулирован Д. И. Менделеевым в году. К этому времени было известно химических элемента. В качестве основного свойства элементов Менделеев выбрал относительную атомную массу. Учитывал также состав, физические и химические свойства образованных элементом простых и сложных веществ.
Расположив все известные химические элементы в порядке возрастания атомных масс, Менделеев обнаружил, что свойства повторяются через определённое число элементов.
Повторим действия Менделеева с учётом того факта, что благородные газы в его время ещё не были известны. Расположим элементы по возрастанию атомной массы (вторая строчка таблицы), укажем металлические и неметаллические свойства, формулы и свойства высших оксидов и гидроксидов, а также формулы газообразных водородных соединений.
Если внимательно проанализировать полученные последовательности, то можно увидеть повторяемость металлических и неметаллических свойств, состава и свойств соединений. Через семь элементов от щелочного металла лития в ряду располагается щелочной металл натрий, а через семь элементов от галогена фтора — галоген хлор. Через семь элементов появляются одинаковые формулы оксидов и водородных соединений, так как повторяются значения валентностей в соединениях с кислородом и водородом. Можем составить их общие формулы.
Таким образом Менделеев установил периодичность изменения свойств с возрастанием атомной массы. В статье «Периодическая закономерность химических элементов» Д. И. Менделеев дал следующую формулировку периодического закона:
«Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от атомного веса».
В переводе на современный научный язык это звучит так:
«Свойства химических элементов и их соединений находятся в периодической зависимости от зарядов атомных ядер».
Для правильного написания химических формул надо знать валентность элементов или степень окисления. Валентностью называется способность атомов данного элемента присоединять или замещать определенное число других атомов. max вал. = 8.
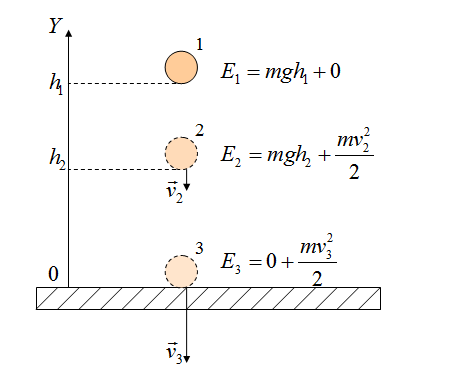
Закон сохранения массы
Закон сохранения энергии можно представить в виде:
Если между телами действуют силы трения, то закон сохранения энергии видоизменяется. Изменение полной механической энергии равно работе сил трения.
Полные механические энергии равны между собой
А куда потом исчезает кинетическая энергия? Исчезает бесследно? Опыт показывает, что механическое движение никогда не исчезает бесследно и никогда оно не возникает само собой. Во время торможения тела произошло нагревание поверхностей. В результате действия сил трения кинетическая энергия не исчезла, а превратилась во внутреннюю энергию теплового движения молекул.
При любых физических взаимодействиях энергия не возникает и не исчезает, а только превращается из одной формы в другую.
Общая форма закона сохранения и превращения энергии имеет вид:
Изучая тепловые процессы, мы будем рассматривать формулу
При исследовании тепловых процессов не рассматривается изменение механической энергии, то есть
В механике процессы теплопередачи не принимают во внимание, то есть
Закон эквивалентов
Эквивалент (Э) – реальная или условная частица вещества, которая может присоединить, заместить в кислотно-основных реакциях один ион водорода (или другого одновалентного элемента), а в окислительно-восстановительных реакциях – присоединить или высвободить один электрон.
Под условной частицей вещества подразумевается реально существующие частицы (молекулы, ионы, электроны и т.д.), доли этих частиц (например, 1 /2 иона) или их группы.
Фактор эквивалентности fэ (х) – число, обозначающее, какая доля реальной частицы вещества X эквивалентна одному иону водорода в кислотно-основной реакции или одному электрону в реакции окисления-восстановления.
Фактор эквивалентности – величина безразмерная. Принимает значения 1 или меньше единицы.
Для простых веществ и элементов в соединении fэ(х) = 1/В, где В – валентность элемента.
Например, для водорода или натрия fэ= 1/1 = 1. Для магния или кислорода fэ = 1/2.
Молярная масса эквивалента вещества Мэ(х) – масса одного моля эквивалента этого вещества, равная произведению фактора эквивалентности fэ(х) на молярную массу вещества Мх.
Например, молярные массы эквивалентов простых веществ:
Мэ(Na) = 1· 23 = 23 г/моль;
Мэ(Mg) = ½ · 24 = 12 г/моль;
Если одно из реагирующих веществ – газ, то для него вводится понятие объема эквивалента вещества – Vэ(х), который рассчитывается на основании следствия из закона Авогадро:
1 моль газа массой М занимает объем 22,4 л, при нормальных условиях (н.у.):
Р o = 1 атм.; Т о = 273 К
1 эквивалент газа массой Мэ занимает объем Vэ при н.у.
Например, при нормальных условиях 1 моль эквивалентов водорода занимает объем, равный:
Для кислорода эта величина составляет
Закон эквивалентов: массы (или объемы) реагирующих веществ пропорциональны молярным массам эквивалентов (или эквивалентным объемам) этих веществ.
Если одно из этих веществ представляет собой газ, то закон эквивалентов записывается в виде
Закон кратных отношений
Относительные атомные и молекулярные массы являются мерой масс атомов и молекул, поэтому они позволяют сделать вывод о соотношении масс атомов различных элементов в молекуле сложного вещества.
Пример: Относительная атомная масса водорода и кислорода соответственно равна 1,00794 и 15,9994, откуда следует, что соотношение масс атомов водорода и кислорода составляет 1 : 16. В молекуле воды H2O содержится два атома водорода и один атом кислорода, следовательно, массовое отношение водорода и кислорода в воде равно 2 : 16 или 1 : 8.
Соотношение атомных масс элементов в соединениях устанавливает закон постоянства состава, вывел его в начале XIX в. французский химик Жозеф Луи Пруст (1754-1826) на основании анализа химических соединений.
Его современная формулировка такова:
Каким бы способом ни было получено вещество, его химический состав остается постоянным
Отсюда следует, что если два или несколько простых веществ соединяются с образованием некоторого сложного вещества, то и массовое отношение реагирующих веществ постоянно для данного продукта. Так, при взаимодействии водорода и кислорода могут быть получены вода H2O и пероксид водорода H2O2; очевидно, что не только в самих продуктах массовое отношение водорода и кислорода равно соответственно 1 : 8 и 1 : 16, но и массовые отношения реагентов будут такими же.
На основании закона постоянства состава и закона кратных отношений английский исследователь Джон Дальтон (John Dalton, 1766-1844) в 1807 г. высказал атомную гипотезу (основу атомно-молекулярного учения о строении вещества):
Из атомной гипотезы вытекает, что закон постоянства состава отражает именно атомный состав вещества: в молекулу вещества объединяется определенное число именно атомов одного или различных элементов.
Закон кратных отношений, открытый Дальтоном, гласит:
Если два элемента образуют между собой несколько соединений, то массы атомов одного элемента, приходящиеся на одну и ту же массу атомов другого элемента, соотносятся между собой как небольшие целые числа.
Закон кратных отношений является фактическим объединением закона сохранения массы и закона постоянства состава на базе атомной гипотезы строения вещества.
Закон объемных отношений (закон Гей-Люссака)
Закон объёмных отношений впервые сформулировал в 1802 г французский учёный-химик Жозеф Луи Гей-Люссак.
Закон объёмных отношений формулируется так:
Объёмы вступающих в реакцию газов относятся друг к другу и к объёмам образующихся продуктов реакции как небольшие целые числа.
При этом подразумевается, что давление и температура неизменны.
Другими словами, стехиометрические коэффициенты в уравнениях химических реакций для молекул газообразных веществ показывают, в каких объёмных отношениях реагируют и получаются газообразные вещества.
При взаимодействии 2 объёмов водорода и 1 объёма кислорода образуются 2 объёма водяного пара.
Закон Авогадро
Изучение свойств газов позволило итальянскому физику А. Авогадро в 1811г. высказать гипотезу, которая впоследствии была подтверждена опытными данными, и стала называться законом Авогадро:
В равных объемах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул.
Из закона Авогадро вытекает важное следствие: моль любого газа при нормальных условиях (0
Из закона Авогадро также следует, что массы равных объемов различных газов при одинаковых температуре и давлении относятся друг к другу как молярные массы этих газов:
М1 и М2 – молекулярные массы первого и второго газов.
Поскольку масса вещества определяется по формуле
где ρ – плотность г аза,
то плотности различных газов при одинаковых условиях пропорциональны их молярным массам. На этом следствии из закона Авогадро основан простейший метод определения молярной массы веществ, находящихся в газообразном состоянии.
Закон Авогадро позволяет рассчитать плотность газа при нормальных условиях, на основании отношения молярной массы М к объему моля:
Из этого уравнения можно определить молярную массу газа:
Следствия из закона Авогадро
Из закона Авогадро вытекают два важных следствия.
Следствие 1 из закона Авогадро. Один моль любого газа при одинаковых условиях занимает одинаковый объем.
В частности при нормальных условиях объем одного моля идеального газа равен 22,4 л. Этот объем называют молярным объемом
Следствие 2 из закона Авогадро. Отношение масс одинаковых объемов двух газов есть величина постоянная для данных газов. Эта величина называется относительной плотностью
Объединенный газовый закон
Реальные газы обычно хорошо подчиняются законам идеальных газов при давлениях, менее или несущественно превышающих атмосферное, и при температурах близких к температуре окружающей среды или более высоких. Поэтому законы идеальных газов находят широкое применение в природопользовании, в частности при расчетах количества, состава газов, выделяющихся при горении, и в других технологических процессах, сопровождаемых их образованием.
Объединенный газовый закон можно также записать в другой форме:
Точное значение постоянной в правой части этого уравнения зависит от количества газа. Если количество газа равно одному молю (см. гл. 4), то соответствующая постоянная обозначается буквой R и называется молярная газовая постоянная, или просто газовая постоянная. Если давление выражено в атмосферах, постоянная R имеет значение
Объединенный газовый закон для одного моля газа приобретает вид:
где Vm- объем одного моля газа. Для п молей газа получается уравнение:
В такой форме объединенный газовый закон называется уравнением состояния идеального газа. Уравнение состояния это уравнение, связывающее между собой параметры состояния газа-давление, объем и температуру.
Газ, который полностью подчиняется уравнению состояния идеального газа, называется идеальный газ. Такой газ не существует в действительности. Реальные газы хорошо подчиняются уравнению состояния идеального газа при низких давлениях и высоких температурах. Отклонения в поведении реальных газов от предписываемш уравнением состояния идеального газа подробно обсуждаются ниже.
Вычисление относительной молекулярной массы с помощью уравнения состояние идеального газа. Уравнение состояния идеального газа позволяет проводить прямые вычисления относительной молекулярной массы газа M1. Введем понятие относительной молекулярной массы, основываясь на уже знакомом нам (из гл. 1) определении относительной атомной массы A1. Для газа, состоящего из простых молекул, относительная молекулярная масса представляет собой сумму относительных атомных масс всех атомов, входящих в молекулу. Например, для диоксида углерода.
где n-количество вещества в молях (т.е. число молей данного вещества), т-масса вещества в граммах, a M-его молярная масса.
Подстановка полученного выражения для п в уравнение состояния идеального газа (4) дает:
Это уравнение позволяет, зная массу и объем газа при определенных температуре и давлении, вычислить его молярную массу М. А поскольку
M = M (г/моль), то полученный результат непосредственно дает относительную молекулярную массу М.
Уравнение Клайперона—Менделеева (для идеального газа)
n – число молей газа;
P – давление газа, Па;
T – абсолютная температура газа, К;
R – универсальная газовая постоянная 8,314 Дж/моль×K.
Если объём газа выражен в литрах, то уравнение Клапейрона-Менделеева записывается в виде:
Из уравнения Клапейрона-Менделеева следует три закона:






















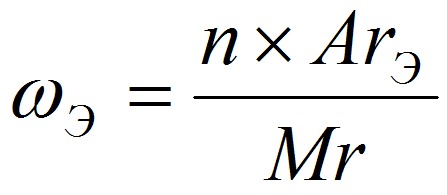
.png)
.png)