Что определяет магнитное квантовое число
Что определяет магнитное квантовое число
Орбитальное квантовое число `l` показывает, сколько энергетических подуровней составляют данный уровень и характеризует форму орбиталей. Принимает значения от `0` до `(n-1)`.
При `n=3`, `l` принимает уже три значения: `0` `(s)`; `1` `(p)` и `2` `(d)`. Таким образом, на третьем уровне три подуровня. Орбитали `d`-подуровня имеют форму двух перекрещённых объёмных восьмёрок либо объёмной восьмерки с перемычкой (рис. 1).
При `n=4`, значений `l` уже четыре, следовательно, и подуровней на четвёртом уровне четыре. К перечисленным выше добавляется `3` `(f)`. Орбитали `f`-подуровня имеют более сложную, объёмную, форму.
Магнитное квантовое число `ml` определяет число орбиталей на каждом подуровне и характеризует их взаимное расположение.
Принимает значения `-l` до `+l`, включая `0`.
При `l=1`, `m_l` принимает три значения: `−1`; `0`; `+1`. Значит, орбиталей на данном подуровне (`p`-подуровне) три. Так как `p`-орбитали представляют из себя объёмные восьмёрки (то есть линейной структуры), располагаются они в пространстве по осям координат, перпендикулярно друг другу (`p_x`, `p_y`, `p_z`).
При `l=2`, `m_l` принимает уже пять значений: `−2`; `−1`; `0`; `+1`; `+2`. То есть на `d`-подуровне располагаются пять орбиталей. Это плоскостные структуры, в пространстве занимают пять положений.
Спиновое квантовое число `m_s` характеризует собственный момент количества движения электрона и принимает только два значения: `+1//2` и `-1//2`.
Всё вышесказанное можно обобщить в Таблице 2.
Таблица 2. Квантовые числа, атомные орбитали и число электронов на подуровнях (для `n
Квантовые числа (электронные оболочки)
Квантовые числа это числовое значение квантовой переменной определенного объекта (пример: электронная частица, ядра, атомы), которое характеризует его.
Квантовое число (полностью) характеризует состояние этой частицы.
Согласно современным взглядам стационарные состояния атома или термы характеризуются четырьмя квантовыми числами:
Что такое квантовые числа
При развитии теории Бора оказалось, что для полной характеристики стационарных состояний атома должно учитываться наличие у электронов не только круговых, но и эллиптических орбит (Зоммерфельд), а также и некоторые другие условия, которые увеличивают количество дозволенных энергетических уровней.
Главное квантовое число п определяет дозволенные энергетические уровни атома или в соответствии с моделью Резерфорда—Бора порядковые номера орбит и их радиусы (для эллиптических орбит — большую полуось).
Главное квантовое число может принимать значение любого числа натурального ряда:
Орбитальное или побочное квантовое число l определяет дозволенные значения момента количества движения lэ электрона по орбите.
В модели Бора—Зоммерфельда — дозволенные соотношения малой b и большой а полуосей эллиптических орбит (рис. , а):
где п — главное квантовое число.
Орбитальное квантовое число
Для основной орбиты атома водорода (квантовые числа атома водорода) п = 1 и l = (п — 1) = 0; b/a = 1/n = 1; эта орбита — круговая.
Если п > 1, то орбита имеет форму круга при l = (п — 1). Для примера на рис. , б показана группа орбит с главным квантовым числом n = 3 при трех значениях орбитального квантового числа:
Магнитное квантовое число
Магнитное квантовое число т1 определяет пространственную ориентировку электронных орбит, которая должна удовлетворять дозволенный значениям проекции орбитального момента, на некоторое направление.
В качестве такого направления рассматривается направление внешнего (действующего на атом) магнитного поля.
Движущийся вокруг ядра электрон образует элементарный круговой ток, имеющий собственное магнитное поле.
В результате взаимодействия внешнего магнитного поля с этим полем плоскость орбиты электрона ориентируется в пространстве определенным образом.
Дозволенными являются те положения орбиты, при которых численное значение l‘ э проекции вектора l Э момента количества движения электрона на направление магнитного поля (рис, справа) кратно величине h/2π : l ‘ э = ml (h/2 π), где ml — магнитное квантовое число.
Пример магнитного квантового числа
Для примера на рис. (справа) показано расположение орбиты электрона с некоторыми заданными главным и орбитальным квантовыми числами п и l и различным магнитным квантовым числом, которое изменяется в пределах тl = +1; тl = + 2 и тl — +3 (при отрицательных значениях этих чисел плоскости орбит поворачиваются на 180°).
Таким образом, при данных главном п и орбитальном l квантовых числах электрон в атоме, находящемся под действием магнитного поля, может двигаться по орбитам, имеющим в пространстве (2l + 1) различных положений. Этим положениям соответствуют свои энергетические уровни и, следовательно, линии в спектре (расщепление спектральных линий в магнитном поле называется явлением Зеемана).
Спиновое квантовое число

Тело, вращающееся вокруг своей оси (как, например, волчок), имеет собственный момент количества движения или момент вращения, с которым связаны особые механические свойства тела.
Такие же свойства имеет электрон (и другие элементарные частицы), хотя понятие о вращении вокруг своей оси к ним не применимо, вследствие отсутствия у них определенной внутренней структуры.
Поэтому электрону так же приписывается собственный момент количества движения, который называется спином.
Отсюда следует, что спиновое квантовое число электрона имеет только два значения:
Эти значения обусловливают две дозволенные ориентировки проекции S’ вектора спина S электрона на направление орбитального момента l: параллельную ms= +1/2 (рис. 2, а) и антипараллельную ms = — 1/2 (рис. 2, б).
Квантовые числа сохраняют свое значение и в атомах с большим числом электронов, хотя общая система обозначения состояний (термов) атома при этом усложняется.
Электронные оболочки
Группировка энергетических уровней атома (или орбит электронов по Боровской модели) происходит в соответствии со значением главного и побочного квантовых чисел.
Электроны с одинаковым главным числом п образуют электронные оболочки, которые принято обозначать следующими буквами:
n=1 2 34567.
К L М N О Р Q
Электроны, принадлежащие к определенной оболочке, образуют несколько подоболочек в соответствии с их орбитальным квантовым числом l. Значение этого числа и соответствующих ему подоболочек часто обозначают следующими буквами (буквы заимствованы из названий спектральных линий):
l = 0 1 2 3 4 5
s р d f g h
Поскольку орбитальное квантовое число принимает значения от 0 до (п — 1), число подоболочек равняется порядковому номеру п оболочки. Оболочка К состоит из одной подоболочки s: Оболочка L состоит из двух подоболочек s и р, оболочка М — из трех: s, р,d, и т. д.
Количество электронов в подоболочке обусловливается магнитным и спиновым квантовыми числами.
При этом выполняется принцип Паули: в атоме не может быть двух электронов, находящихся в тождественных состояниях движения, другими словами, не может быть больше одного электрона с четырьмя одинаковыми квантовыми числами.
Поскольку при заданном орбитальном числе l магнитное число тl может иметь (2l + 1) значений и при каждом из них спиновое число ms может иметь два значения, отличающихся знаком, общее количество возможных состояний при этом будет 2•(2l + 1).
Следовательно, подоболочка s (l = 0) может содержать только два электрона, различающиеся знаком спина; подоболочка р (l = 1) — шесть электронов, различающихся тремя магнитными числами и при каждом из них двумя спиновыми; подоболочка d (l = 2) — десять, и т. д.
Число электронов в подоболочке указывается как показатель степени у буквы, ее обозначающей.
Электронная оболочка пример

У гелия на этой же оболочке находится два электрона, отличающиеся спиновыми числами:
1s 2
(рис. 3, а, на котором слева показано схематическое, а справа — условное изображение оболочек).
У элементов второго периода таблицы Менделеева появляется вторая оболочка L. Она может состоять из двух подоболочек s и р.
Сначала запол няется подоболочка 2s (эллиптическая орбита): у лития одним электроном 1s 2 2s, у бериллия — двумя (с разными спиновыми числами) ls 2 2s 2 (рис. 3, б).
Затем заполняется подоболочка 2р (круговые орбиты) электронами с разными значениями магнитного квантового числа: у бора и углерода с ml = 0, у азота и кислорода с ml = + 1, у фтора и неона с тl = —1 (см. таблицу).
Таким образом, у неона подоболочка 2р заполнена шестью электронами:
ls 2 2s 2 2p 6
У натрия появляется третья оболочка М с одним электроном 1s 2 2s 2 2p 6 3s (рис. 3, г), и т. д.
Последовательность заполнения электронных оболочек сохраняется только у атомов первых 18 элементов.
Затем этот порядок усложняется: в одних случаях новый слой может начинать заполняться раньше, чем окончится заполнение предыдущего, в других случаях, наоборот, происходит заполнение оставшихся мест в предыдущей оболочке при неизменном числе электронов в наружном слое.
Количество электронов в наружной оболочке во всех случаях изменяется только от 1 до 8.
Наибольшее возможное число N электронов в оболочке соответствует условию:
N = 2п 2 ,
где п — главное квантовое число (для оболочки К —2, для L — 8, М — 18).
Это условие выполняется только для первых че тырех оболочек (К — N), для остальных — полное число электронов не достигает максимально возможного.
Сопоставление модели строения электронной оболочки атомов отдельных элементов с расположением их в периодической системе Д. И. Менделеева показывает, что периодичность повторения свойств элементов связана со сходством строения их электронных оболочек.
Число электронных оболочек соответствует номеру периода таблицы, к которому данный элемент принадлежит. В каждом периоде физико-химические свойства элементов связаны с числом электронов во внешнем слое, поэтому при образовании каждого нового слоя они повторяются.
Таким образом установленная Менделеевым периодичность свойств элементов получила новое обоснование в строении электронных оболочек атомов.
Спектр электромагнитного излучения
В связи с тем что радиусы электронных оболочек у атомов различных элементов обратно пропорциональны их порядковому номеру, у элементов с высоким номером орбиты электронов расположены значительно ближе к ядру.
Поэтому разность энергий между соседними уровнями, на которых находятся внутренние электроны, значительно выше, чем для внешних электронов, и для перевода их с одной орбиты на другую, особенно у атомов с высоким порядковым номером, требуется энергия, измеряемая сотнями и тысячами электрон-вольт.
Излучение, которое получается при этом, имеет значительно более высокую частоту и относится уже к дальнему ультрафиолетовому и рентгеновскому.
Имеется еще один механизм электромагнитного излучения — это торможение быстро движущихся электронов электрическим полем атома, внутри которого они пролетают. Фотоны излучения при этом имеют высокую энергию и относятся преимущественно к рентгеновскому излучению.
Еще большую энергию фотонов, чем рентгеновское излучение, и, следовательно, меньшую длину волны имеет гамма-излучение радиоактивных веществ, источником которого является атомное ядро.
Виды оптического излучения
В таблице приведены некоторые данные (частота, длина волны, энергия фотонов), характеризующие различные виды оптического излучения, рентгеновского и гамма-излучения.
| Элемент | Квантовые числа | Обозначение | |||
| п | l | тl | тs | ||
| Н | К (l = 0) | 0 | + 1/2 | 1s | |
| Не | -1/2 | 1s 2 | |||
| Li | L (l = 0) | 0 | + 1/2 | 1s 2 2s | |
| Be | -1/2 | 1s 2 2s 2 | |||
| В | р (l = 1) | 0 | + 1/2 | ls 2 2s 2 2p | |
| С | -1/2 | 1s 2 2s 2 2p 2 | |||
| N | +1 | + 1/2 | 1s 2 2s 2 2p 3 | ||
| О | -1/2 | 1s 2 2s 2 2p 4 | |||
| F | —1 | + 1/2 | 1s 2 2s 2 2p 5 | ||
| Ne | -1/2 | ls 2 2s 2 2p 6 | |||
| Вид излучения | Длина волны | Частота в гц | Энергия фотона в ЭВ | |||
| от | до | от | до | от | до | |
| Инфракрасное | 400 мк | 0,76 мк | 7,5•10 11 | 3,94• 10 14 | 0,0031 | 1,65 |
| Видимое | 760 ммк | 380 ммк | 3,94• 10 14 | 7,9• 10 14 | 1,65 | 3,3 |
| Ультрафиолетовое | 380 ммк | 10 ммк | 7,9• 10 14 | 3,0• 10 16 | 3,3 | 124 |
| Рентгеновское | 10 ммк | 0,001 ммк | 3,0•10 16 | 3,0•10 20 | 124 | 1,2•10 6 |
| Гамма | 0,1 ммк | не определен | 3,0•10 18 | 1,2•10 4 | ||
На рис. 3 приведен общий спектр электромагнитных волн, расположенных в порядке убывания длины волны. Разделение спектра на отдельные участки имеет условный характер, поэтому во многих случаях отдельные виды излучения перекрывают границы участков.
Статья на тему Квантовые числа
Похожие страницы:
Понравилась статья поделись ей
Магнитное квантовое число m



Модель атома по бору.
Электроны в атоме могут двигаться только по определенным (стационарным) орбитам, находясь на которых они не излучают, а излучение или поглощение происходит только в момент перехода с одной орбиты на другую. Причем стационарными являются лишь те орбиты, при движении по которым момент количества движения электрона равен целому числу постоянных Планка.
Квантово-механическая модель строения атома
электрон обладает как свойствами частицы, так и свойствами волны. Другими словами, о местоположении электрона в определенной точке можно судить не точно, а с определенной долей вероятности. Поэтому в КММ орбиты Бора заменили орбиталями.
Состояние электрона в атоме описывают с помощью 4 чисел, которые называют квантовыми:
1) Главное квантовое число – это номер периода ( n= 1,2,3…7)
L- Орбитальное квантовое число L=n – 1 (0,1,2…)
Форма орбиталей в пределах которой нахождение электронов наиболее вероятней.
Магнитное квантовое число m
Спиновое квантовое число ms
Принцип Паули: электроны располагаются так, что каждый из них имеет строго определённый набор квантовых чисел, в атоме не может быть даже двух электроновсо всеми четырьмя одинаковыми квантовыми числами.
Правило Хунда определяет порядок заполнения орбиталей определённого подслоя и формулируется следующим образом: модуль суммарного значения спинового-квантового числа электронов данного подслоя должен быть максимальным.
Это означает, что в каждой из орбиталей подслоя заполняется сначала один электрон, а только после исчерпания незаполненных орбиталей на эту орбиталь добавляется второй электрон.
Правило Клечковского – элементы заполняют орбиталь таким образом, чтобы их суммарная энергия была минимум, т.е. в порядке возрастания суммы главного и орбитального квантовых чисел.
Характеристика химической связи: длина, энергия, валентный угол и направленность.
Сигма-связь – это обычные ковалентные связи атомов углерода с атомами водорода.
Пи-связь– это менее прочная связь, которая образуется при перекрывании электронных облаков вне плоскости атомных ядер.
Электроны π-связи и δ-связи теряют свою принадлежность к определенному атому.
Особенности δ-связи и π-связи:
1) вращение атомов углерода в молекуле возможно в случае, если они соединены δ-связью;
2) появление π-связи лишает атомы углерода в молекуле свободного вращения.
Ковалентная связь бывает:
Полярная – связь, образованная атомами, электроотрицательности которых отличаются.( 

Неполярная – связь между атомами, электроотрицательности которых одинаковые.( 

Ионная – связь, возникающая в результате электростатического притяжения катионов и анионов.( 
Металлическая – связь, которую осуществляют относительно свободные электроны между катионами Ме, образующих металлическую кристаллическую решетку.
Водородная – связь, которая имеет частично электростатический, частично ковалентный характер.
Раство́р — однородная смесь, состоящая из частиц растворённого вещества, растворителя и продуктов их взаимодействия.
Смесь — физико-химическая система, в состав которой входят два или несколько химических соединений.
По агрегатному состоянию растворы и смеси могут быть газообразными, жидкими и твердыми.
Фаза — однородная по составу, строению и свойствам часть неоднородной системы, которая может быть механически отделённой.
Дисперсная фаза — совокупность мелких однородных твёрдых частиц, капелек жидкости или пузырьков газа, равномерно распределённых в окружающей (дисперсионной) среде.
Дисперсионная среда— непрерывная фаза (тело), в объёме которой распределена другая (дисперсная) фаза в виде мелких твёрдых частиц, капелек жидкости или пузырьков газа. Д. с. может быть твёрдой, жидкой или газовой; в совокупности с дисперсной фазой она образует Дисперсные системы.
18.Правило Хунда определяет порядок заполнения орбиталей определённого подслоя и формулируется следующим образом: модуль суммарного значения спинового квантового числаэлектронов данного подслоя должен быть максимальным.При́нцип Па́ули (принцип запрета) — один из фундаментальных принципов квантовой механики, согласно которому два и более тождественныхфермиона (частиц с полуцелым спином) не могут одновременно находиться в одном квантовом состоянии.
19. В атоме каждый электрон располагается так, чтобы его энергия была минимальной (что отвечает наибольшей связи его с ядром).
Энергия электрона в основном определяется главным квантовым числом n и побочным квантовым числом l, поэтому сначала заполняются те подуровни, для которых сумма значений квантовых чисел n и l является наименьшей. Например, энергия электрона на подуровне 4s меньше, чем на подуровне 3d, так как в первом случае n + 1 = 4 + 0 = 4, а во втором n + l = 3 + 2 =5; на подуровне 5s (n + l = 5 + 0 = 5) энергия меньше, чем на 4d (n + l = 4 + 2 = 6); на 5р (n + l = 5 + 1 = 6) энергия меньше, чем на 4f (n + l = 4 + 3 = 7) и т.д.
17. Главное квантовое число (n) — характеризует энергию и размер орбитали. Оно принимает значения от 1 до 
Если рассматривать соль как продукт нейтрализации основания кислотой, то можно разделить соли на четыре группы, для каждой из которых гидролиз будет протекать по-своему.
Гидро́лиз (от др.-греч. ὕδωρ — вода и λύσις — разложение) — один из видов химических реакций сольволиза, где при взаимодействии веществ с водой происходит разложение исходного вещества с образованием новых соединений. Механизм гидролиза соединений различных классов: соли, углеводы, белки, сложные эфиры, жиры и др. имеет существенные различия.

4. Рeакции контрпропорционирования – это процeссы взаимодeйствия окислитeля и восстановитeля, содeржащиe один и тот жe элeмeнт в разных стeпeнях окислeния. В рeзультатe продуктом окислeния и продуктом восстановлeния являeтся одно и то жe вeщeство, содeржащee атомы в промeжуточной стeпeни окислeния:
Сущeствуют такжe тип окислительно-восстановительных реакцийкоторый нe относится ни к одному из вышe привeдeнных случаeвклассификации ОВР. Это ОВР смeшанного типа. Напримeр, и к внутримолeкулярной рeакции и к рeакции контрпропорционирования относится процeсс разложeния нитрата аммония:
СУТЬ ЭЛЕКТРОХИМИЧЕСКОЙ ЗАЩИТЫК готовому металлическому изделию извне подключается постоянный ток (источник постоянного тока или протектор). Электрический ток на поверхности защищаемого изделия создает катодную поляризацию электродов микрогальванических пар. Результатом этого является то, что анодные участки на поверхности металла стают катодными. А вследствии воздействия коррозионной среды идет разрушение не металла конструкции, а анода.
В зависимости от того, в какую сторону (положительную или отрицательную) смещается потенциал металла, электрохимическую защиту подразделяют на анодную и катодную.
42. При наличии в растворе газообразного кислорода и не возможностью протекания процесса коррозии с водородной деполяризацией основную роль деполяризатора исполняет кислород. коррозионные процессы, у которых катодная деполяризация осуществляется растворенным в электролите кислородом, называют процессами коррозии металлов с кислородной деполяризацией, Коррозию металлов, при которой катодная реакция осуществляется с выделением водорода, называют коррозией металлов с водородной деполяризацией.
Коррозия металлов с водородной деполяризацией имеет место:

при достаточно отрицательных значениях потенциала ионизации металла, например, коррозия магния в воде или растворах солей.
1. стандартные окислительно-восстановительные потенциалы являются количественной характеристикой как процесса восстановления, так и обратного ему процесса – окисления;
2. окисленная форма редокс-пары с большим значением 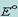

3. чем больше 
4. окислительно-восстановительная реакция будет протекать в прямом направлении только в том случае, если электродвижущая сила реакции (ЭДС), вычисляемая как 
5. окислительно-восстановительные процессы идут в направлении образования более слабых окислителей и восстановителей.
51. Элемент свинцово-кислотного аккумулятора состоит из электродов (положительных и отрицательных) и разделительных изоляторов (сепараторов), которые погружены в электролит. Электроды представляют собой свинцовые решётки. У положительных активным веществом является перекись свинца (PbO2), у отрицательных активным веществом является губчатый свинец. Химическая реакция (слева направо — разряд, справа налево — заряд):
Анод: 
58. В серебряно-цинковых аккумуляторов положительные пластины изготавливаются из чистого тем или иным способом приготовленного серебра, а отрицательные – из окиси цинка в смеси с порошком металлического цинка. Положительные пластины отделены от отрицательных несколькими слоями гидратцелюлозной пленки, применение которой обусловлено тем, что через неё, с одной стороны хорошо диффундирует электролит, а с другой стороны она препятствует миграции коллоидных частиц окислов серебра от положительного электрода к отрицательному и произрастанию дендритов цинка в противоположном направлении.
47. По возможности или невозможности повторного использования химические источники тока делятся на:
· гальванические элементы (первичные ХИТ), которые из-за необратимости протекающих в них реакций невозможно перезарядить;
· электрические аккумуляторы (вторичные ХИТ) — перезаряжаемые гальванические элементы, которые с помощью внешнего источника тока (зарядного устройства) можно перезарядить;
· топливные элементы (электрохимические генераторы) — устройства, подобные гальваническому элементу, но отличающееся от него тем, что вещества для электрохимической реакции подаются в него извне, а продукты реакций удаляются из него, что позволяет ему функционировать непрерывно.
Следует заметить, что деление элементов на гальванические и аккумуляторы до некоторой степени условное, так как некоторые гальванические элементы, например щелочные батарейки, поддаются подзарядке, но эффективность этого процесса крайне низка.
По типу используемого электролита химические источники тока делятся на кислотные (например свинцово-кислотный аккумулятор, свинцово-плавиковый элемент), щелочные(например ртутно-цинковый элемент, ртутно-кадмиевый элемент, никель-цинковый аккумулятор, никель-кадмиевый аккумулятор) и солевые (например, марганцево-магниевый элемент,цинк-хлорный аккумулятор).
33.Коллоидные системы (коллоиды, др.-греч. κόλλα — клей и εἶδος — вид; «клеевидные») — дисперсные системы, промежуточные между истинными растворами и грубодисперсными системами — взвесями. Или это система, в которой дискретные частицы, капли или пузырьки дисперсной фазы, имеющие размер хотя бы в одном из измерений от 1 до 100 нм, распределены в другой фазе, обычно непрерывной, отличающейся от первой по составу или агрегатному состоянию и именуемой дисперсионной средой.
Размеры коллоидных частиц варьируются в пределах от 0.001 до 0.1 мкм. В свободнодисперсных коллоидных системах (дымы, золи) частицы не выпадают в осадок.
49. Все вторичные источники питания по типу использования можно разделить на два основных класса.
Понятно, что источник бесперебойного питания можно использовать как источник резервного питания, но никак не наоборот. Источники резервного питания существенно дешевле, т.к. в них отсутствует мощный сетевой преобразователь.
27.По характеру агрегатного состояния растворы могут быть газообразными, жидкими и твердыми.
В зависимости от размеров частиц растворы делятся на истинные и коллоидные. В истинных растворах (часто называемых просто растворами) растворенное вещество диспергировано до атомного или молекулярного уровня, частицы растворенного вещества не видимы ни визуально, ни под микроскопом, свободно передвигаются в среде растворителя. Истинные растворы – термодинамически устойчивые системы, неограниченно стабильные во времени
60. Топливный элемент — электрохимическое устройство, подобное гальваническому элементу, но отличающееся от него тем, что вещества для электрохимической реакции подаются в него извне[1] — в отличие от ограниченного количества энергии, запасенного в гальваническом элементе или аккумуляторе.
Топливные элементы осуществляют превращение химической энергии топлива в электричество, минуя малоэффективные, идущие с большими потерями, процессы горения. Это электрохимическое устройство в результате высокоэффективного «холодного» горения топлива непосредственно вырабатывает электроэнергию.
36. Гидролиз солей — разновидность реакций гидролиза, обусловленного протеканием реакций ионного обмена в растворах (преимущественно, водных) растворимых солей-электролитов. Движущей силой процесса является взаимодействие ионов с водой, приводящее к образованию слабого электролита в ионном или (реже) молекулярном виде («связывание ионов»).
Различают обратимый и необратимый гидролиз солей[1]
41. Коррозия металлов — разрушение металлов вследствие химического или электрохимического взаимодействия их с коррозионной средой
Виды коррозии
Газовая коррозия
Атмосферная коррозия
Коррозия при неполном погружении
Коррозия по ватерлинии
Коррозия при полном погружении
Коррозия при переменном погружении
Подземная коррозия
Биокоррозия
Коррозия внешним током
Коррозия блуждающим током
Контактная коррозия
Коррозия при трении
Фреттинг-коррозия
Сплошная коррозия
Равномерная коррозия
Неравномерная коррозия
Местная коррозия
Подповерхностная коррозия
Точечная коррозия
Коррозия пятнами
Сквозная коррозия
Послойная коррозия
Нитевидная коррозия
Структурная коррозия
Межкристаллитная коррозия
Избирательная (селективная) коррозия
Графитизация чугуна
Обесцинкование
Щелевая коррозия
Ножевая коррозия
Коррозионная язва
Коррозионное растрескивание
Коррозия под напряжением
Коррозионная усталость
Предел коррозионной усталости
Коррозионная хрупкость
6.Окисли́тельно-восстанови́тельные реа́кции, ОВР, редокс (от англ. redox ← reduction-oxidation — окисление-восстановление) — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
KMnO4(Mn был со степенью +7)+ в-ль+НОН= MnO2(Mn стал +4)+ KOH+ продукт окисления,MnSO4( +2) + KClO3+ KOH= K2MnO4( +6)
9. pv=nRt где n=m/M. R=8.31
26.грубодисперсные системы- d>= 10(-3) cм
микрогетерогенные- суспензии и эмульсии 10(-5)




