Что не является аллотропной модификацией углерода фуллерен графит активированный уголь
Творческие проекты и работы учащихся
В индивидуальной исследовательской работе по химии «Углерод и его аллотропные модификации» автор изучает литературу по теме исследования и подробно рассказывает об аллотропных модификациях углерода, о химических и физических свойствах, а также знакомится с её видами.
Подробнее о проекте:
Учащаяся института профессионального образования в рамках своего проекта на тему «Углерод и его аллотропные модификации» изучила такие аллотропные модификации углерода, как алмаз, графит и фуллерен, описала историю их открытия и структуру каждого рассматриваемого вещества. Также изучены и представлены физические и химические свойства алмаза, графита и фуллерена.
Оглавление
Введение
1. Понятие аллотропии.
2. Аллотропные модификации углерода.
3. Алмаз.
4. Графит.
5. Фуллерен.
6. Физические свойства.
7. Химические свойства.
8. Практическая часть.
Заключение
Список использованной литературы
Введение
Углерод и его аллотропные модификации имеют большое практическое значение в жизни человека и промышленности.
Цель исследования: Подробно рассказать об аллотропных модификациях углерода, о химических и физических свойствах, а также ознакомиться с её видами.
Понятие аллотропии
Понятия «Аллотропия» имеет древнегреческие корни: αλλος — другой, τροπος — свойство. Аллотропия — существование двух и более простых веществ одного и того же химического элемента. Понятие аллотропии введено в науку Й. Берцелиусом в 1841 году для обозначения разных форм существования элементов.
Явление аллотропии подразумевает возможность создания из одного и того же элемента определенного количества различных веществ. Например, кислород и озон в своем составе содержат только лишь оксиген. Вопрос о том, как это вообще возможно, на протяжении длительного периода времени интересовал многих людей. На сегодняшний момент ученые легко могут объяснить все особенности этого процесса.
Далеко не все элементы способны образовывать несколько разных простых веществ. Такая способность напрямую зависит от структуры молекул. Чаще всего подобное явление наблюдается у элементов, которые имеют переменные окислительные степени.
Это касается таких групп, как:
Причины аллотропии могут быть нескольких типов. К наиболее вероятным из них ученые относят такие факторы, как:
Для того чтобы наглядно понять, каким образом может существовать явление аллотропии, необходимо рассмотреть несколько наиболее примечательных примеров, широко встречающихся в природе.
При нагревании металлов в процессе превращения поглощается тепло, при этом изменение решеточной конструкции происходит при одной и той же температуре. Аллотропным модификациям подвергаются многие металлы, например, титан, железо, олово и др. Железо при нагревании до +1390 ºС характеризуется гранецентрированной решеткой. Повышение температуры до +1540 ºС ведет к перестройке до центрировано-кубической структуры.
Аллотропные модификации углерода
Углерод в виде угля, копоти и сажи известен человеку с незапамятных времен; около 100 тыс. лет назад, когда наши предки овладели огнём. Вероятно, очень рано люди познакомились и с аллотропными изменениями углерода – алмазом и графитом, а также с ископаемым углем. Не удивительно, что горение углеродсодержащих веществ было одними из первых химических процессов, заинтересовавших человека.
Элементом был огонь-явление, сопровождающее горение; в учениях об элементах древности огонь обычно фигурирует в качестве одного из элементов. На рубеже XVII-XVIII вв. возникла теория флогистона, выдвинутая Бехером и Шталем. Эта теория признавала наличие в каждом горючем теле особого элементарного вещества – невесомого флюида-флогистона, улетучивающегося в процессе горения.
В книге Гитона де Морво, Лавуазье и Фуркруа «Метод химической номенклатуры» (1787) появилось название «углерода» вместо французского «чистый уголь». Под этим же названием углерод фигурирует в «Таблице простых тел» в «Элементарном учебнике химии» Лавуазье. В 1791 году английский химик Теннант первым получил свободный углерод; он пропускал пары фосфора над прокаленным мелом, в результате чего образовывался фосфат кальция и углерод. То, что алмаз при сильном нагревании сгорает без остатка, было известно давно.
Еще в 1751 году французский король Франц I согласился дать алмаз и рубин для опытов по сжиганию. Оказалось, что сгорает лишь алмаз, а рубин (окись алюминия с примесью хрома) выдерживает без повреждения длительное нагревание в фокусе зажигательной линзы. Лавуазье поставил новый опыт по сжиганию алмаза с помощью большой зажигательной машины, пришел к выводу, что алмаз представляет собой кристаллический углерод.
Второй аллотроп углерода – графит в алхимическом периоде считался видоизмененным свинцовым блеском и назывался plumbago; только в 1740 году Потт обнаружил отсутствие в графите какой – либо примеси свинца. Шееле исследовал графит (1779) и будучи флогистиком счел его сернистым телом особого рода, особым минеральным углем, содержащим связанную «воздушную кислоту» (СО2) и большое количество флогистона. Двадцать лет спустя Гитон де Морво путем осторожного нагревания превратил алмаз в графит, а затем в угольную кислоту.
Международное название Carboneum происходит от латинского carbo (уголь). Слово это очень древнего происхождения. Его сопоставляют с cremare – гореть; корень car, cal, русское гар, гал и гол, санскритское cra означает кипятить, варить. Со словом «carbo» связаны названия углерода и на других европейских языках (carbon, charbone и др.). Немецкое Kohlenstoff происходит от Kohle – уголь.
Древнерусское угорати, или угарати (обжигать, опалять) имеет корень гар, или гор, с возможным переходом в гол; уголь по-древнерусски югъль, или угъль, того же происхождения. Слово алмаз происходит от древнегреческого – несокрушимый, непреклонный, твердый, а графит от греческого – пишу. В начале XIX в. Старое слово уголь в русской химической литературе иногда заменялось словом «углетвор» (шере, 1807; Севергин, 1815); с 1824 г. Соловьев ввел название углерод.
Алмаз
Согласно современным теоретическим представлениям, тверже алмаза ничего в мире быть не может — такова у него кристаллическая решетка. Можно сказать, что алмаз — самый крепкий минерал в мире. Плавится алмаз при высоких температурах, от 3700 до 4 тыс. градусов. Но еще раньше, при 850 градусах, он начинает гореть, а без доступа воздуха при достижении половины от температуры плавления превращается в графит.
Алмазы не всегда были драгоценными камнями, имевшими ценность и шкалу стоимости. В природе этот камушек непривлекателен — простая шершавая стекляшка. Ценность ему придает огранка. Все изменилось в XIX веке, когда в Южной Африке около современного города Кимберли на ферме братьев де Бирс обосновались искатели алмазов. Камней на этих землях было много. Настоящая промышленная их добыча стала связана с именем Сесиля Родса.
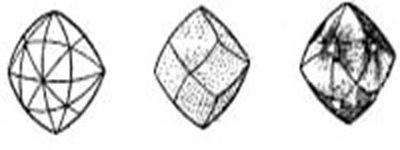
Сесиль Родс стал монополистом на рынке алмазов, чему поспособствовали Ротшильды, а бриллианты стали потребительским товаром, доступным не только королям. Монопольное положение де Бирс пошатнулось только в середине XX века благодаря антимонопольному законодательству в США и началу массовой добычи в странах, где возможностей захвата рынка в принципе не было — например, в СССР. Существует несколько способов огранки алмазов, при которой они лучше всего проявляют такое свое свойство, как игру цвета. Играет свою роль и исходная форма камня, поскольку огранщик старается свести его потери к минимуму.
Наиболее распространенными формами бриллианта являются:
Графит
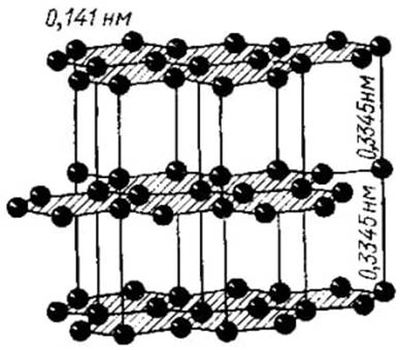
Графи́т — минерал из класса самородных элементов, одна из аллотропных модификаций углерода. Структура слоистая. Слои кристаллической решётки могут по-разному располагаться относительно друг друга, образуя целый ряд политипов, с симметрией от гексагональной сингонии (дигексагонально-дипирамидальный), до тригональной (дитригонально-скаленоэдрический).
Слои слабоволнистые, почти плоские, состоят из шестиугольных слоёв атомов углерода.
Физические свойства в графите сильно различаются по направлениям – перпендикулярному и параллельному слоям атомов углерода.
При нагревании без доступа воздуха графит не претерпевает никаких изменений до 3700°С. При указанной температуре он возгоняется, не плавясь.
Искусственный графит получают из лучших сортов каменного угля при 3000°С в электрических печах без доступа воздуха.
Графит термодинамически устойчив в широком интервале температур и давлений, поэтому он принимается в качестве стандартного состояния углерода. Плотность графита составляет 2,265 г/см3.
Известны две формы графита: альфа-графит (имеет гексагональную структуру и кристаллическую решетку) и бета-графит (имеет ромбоэдрическую структуру и кристаллическую решетку). У α-графита половина атомов каждого слоя располагается над и под центрами шестиугольника, а у β-графита каждый четвёртый слой повторяет первый.
Альфа-графит может быть преобразован в бета-форму с помощью механической обработки. Бета-форма переходит в альфа-форму при нагревании графита свыше 1300 °C.
Фуллерен
Открытие фуллерена произошло в результате экспериментов Смолли и Крото с инструментом, который Смолли изобрел для изучения молекул и атомных кластеров. Крото заинтересовала предложенная Смолли методика лазерного испарения. С ее помощью он намеревался проверить свою теорию о поведении углерода в межзвездном пространстве. Крото считал, что богатые углеродом красные гиганты способны испускать сложные углеродные соединения, которые можно обнаруживать с помощью радиотелескопов.
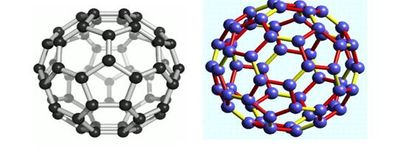
Атом связь Фуллерен является новой аллотропной формой углерода. Молекулы фуллерена состоят из 60,70 атомов, образующих сферу. Кристаллические фуллерены представляют собой полупроводники. Разнообразие физико-химических и структурных свойств соединений на основе фуллеренов позволяет говорить о химии фуллеренов как о новом перспективном направлении органической химии.
Атомы углерода расположены в вершинах правильных шести- и пятиугольников, из которых составлена поверхность сферы или эллипсоида. Самый симметричный и наиболее полно изученный представитель семейства фуллеренов фуллерен (C60), в котором углеродные атомы образуют усечённый икосаэдр, состоящий из 20 шестиугольников и 12 пятиугольников и напоминающий футбольный мяч.
Следующим по распространённости является фуллерен C70, отличающийся от фуллерена C60 вставкой пояса из 10 атомов углерода в экваториальную область C60, в результате чего молекула C70 оказывается вытянутой и напоминает своей формой мяч для игры в регби. Так называемые высшие фуллерены, содержащие большее число атомов углерода (до 400), образуются в значительно меньших количествах и часто имеют довольно сложный изомерный состав. Среди наиболее изученных высших фуллеренов можно выделить Cn, n=74, 76, 78, 80, 82 и 84.
Физические свойства
Физические свойства. Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими свойствами. Разнообразие модификаций обусловлено способностью углерода образовывать химические связи разного типа.
Поэтому разные модификации проявляют очень разные физические свойства это и очень твердое вещество, и мягкое вещество проводящее электрический ток и многие другие.
Алмаз:
Физ. свойства. Алмаз и графит резко отличаются по физ. Свойствам. Алмаз – прозрачные кристаллы, очень твердые. Твердость объясняется строением его кристаллической решетки. Графит – мягкое темно-серое вещ-во с Ме блеском.
Графит:
Фуллерен:
Физические свойства фуллерена Конденсированные системы, состоящие из молекул фуллеренов, называются фуллеритами. Наиболее изученная система такого рода — кристалл С60, менее — система кристаллического С70. Исследования кристаллов высших фуллеренов затруднены сложностью их получения.
Химические свойства
Алмаз:
При обычной температуре углерод малоактивен. Он может быть, как восстановителем, так и окислителем. Как восстановитель: Горит на воздухе.
Графит:
Химические свойства. Со многими веществами (щелочными металлами, солями) образует соединения включения. Реагирует при высокой температуре с воздухом, сгорая до углекислого газа.
Фуллерен:
Восстановление, нуклеофильное присоединение, цикло присоединение, региохимическое множественное присоединение, галогенирование, модифицирование фуллеренов, кластерами гидрирование, присоединение радикалов, образование комплексов, переходных металлов окисление и реакции с электрофильными реагентами.
Практическая часть
Новая аллотропная модификация:
C18 был получен путём удаления монооксида углерода из молекулы C24O6 принципом атомно-силовой микроскопии на двухслойной поверхности хлорида натрия при температуре 5°K (-268,15°С). По мнению учёных, циклоуглероды могут оказаться полезными в компьютерных технологиях в качестве чрезвычайно энергоэффективного компьютерного логического устройства. Кроме того, создание С18 открывает путь для синтеза других углеродных аллотропов, но пока что предстоит глубокое изучение свойств новой молекулы.
Заключение
Углерод — вещество с самым большим числом аллотропических модификаций. В проекте рассмотрены аллотропные модификации алмаза, графита, фуллерена. Углерод и его аллотропные модификации имеют большое практическое значение в жизни человека и промышленности.
Большинство вещей в нашей жизни мы получили благодаря аллотропным модификациям, например, сверло, чёрные графитовые карандаши и батарейки.
Благодаря этому проекту мы узнала, как и кто помог нам в улучшении нашей жизни.
Исходя из всей проделанной работы, мы можем сделать следующие выводы:
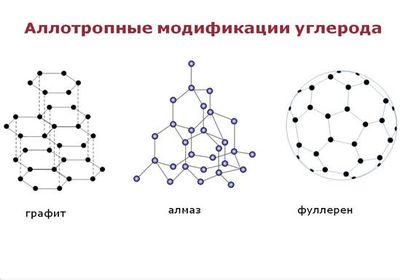
Аллотропные модификации углерода

Всего получено оценок: 198.
Всего получено оценок: 198.
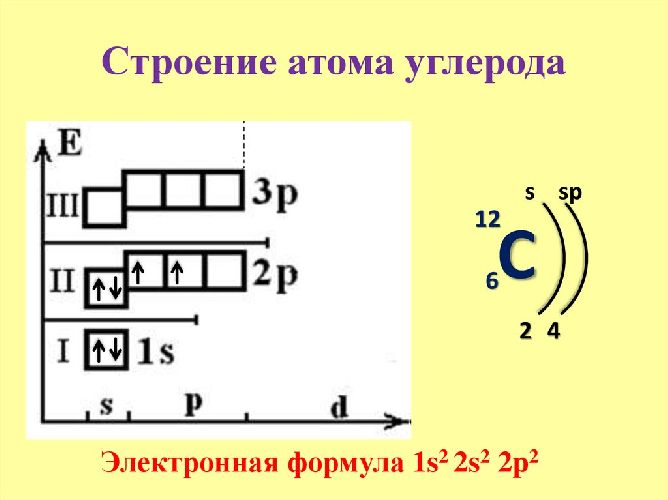
Соединения, образованные атомами углерода, но отличающиеся строением и свойствами, называются аллотропными модификациями углерода. Основными модификациями углерода являются графит, алмаз, карбин.
Классификация
Возможность присоединять четыре атома делает углерод активным элементом. Помимо присоединения атомов других элементов углерод может образовывать различные модификации, отличающиеся структурой и свойствами.
Выделяют два вида углерода в зависимости от образования модификаций:
Кристаллические формы углерода:
В соответствии с геометрическим строением кристаллической решётки выделяют три типа аллотропных модификаций:
Аморфный углерод образует следующие модификации:
Лонсдейлит является гексагональной модификацией алмаза. Наноалмазы, фуллерены, нанотрубки, нанографиты объединены в семейство наноуглеродных кластеров. Они образованы вложенными друг в друга углеродными сферами.
Основные модификации
Наиболее изучены твёрдые формы углерода – алмаз, графит и карбин. Особенности строения и свойства аллотропных модификаций углерода представлены в таблице.
Модификация
Строение решётки
Свойства
Применение
Смазка в прокатном производстве. За счёт отслоения тригональной решётки используется в качестве стержня карандаша
Мелкокристаллический порошок с небольшой плотностью. Полупроводник
Используется в фотоэлементах
Прозрачный минерал, обладающий наибольшей твёрдостью. Обладает теплопроводностью, является полупроводником. Имеет большой показатель преломления. Плавится при температуре 3700°C
Драгоценный камень, абразив. Из алмаза изготавливают свёрла, ножи, резцы
При сильном нагревании графит переходит в алмаз, а алмаз – в графит.
Что мы узнали?
Углерод имеет множество аллотропных модификаций. Основные из них – графит, алмаз, карбин. Они отличаются друг от друга физическими, химическими свойствами, строением кристаллической решётки. Наиболее твёрдая модификация – алмаз – используется для изготовления промышленных инструментов. Графит – мягкий минерал – применяется в прокатной промышленности. Благодаря строению способен отслаиваться, оставляя след, поэтому используется в качестве карандашного стержня. Карбин – порошок, который используется в фотоэлементах.
Презентация по химии на тему Аллотропная модификация углерода» ( 9 класс)
Описание презентации по отдельным слайдам:
Описание слайда:
Аллотропные модификации углерода
Выполнила:
Анисимова Вероника,
ученица 9 «Б» класса.
Проверила:
Попельницкая Светлана Анатольевна,
учитель химии и ОБЖ.
Описание слайда:
Цель работы:
выявление и установление аллотропных модификаций углерода.
Познакомиться с понятием «аллотропия»;
Рассмотреть, какие есть аллотропные модификации углерода;
подвести итог
Описание слайда:
Область соединений углерода так велика, что составляет особую отрасль химии, т. е. химии углеродистых, или, лучше, углеводородных, соединений. Д. И. Менделеев, «Основы химии»
Описание слайда:
Описание слайда:
Аллотропия
Аллотропия – это явление существования двух и более простых веществ одного и того же химического элемента, но различных по своему строению и соответственно свойствам. Все формы и модификации таких веществ называют аллотропными.
Описание слайда:
Аллотропные модификации углерода
Алмаз
Графит
Карбин
Фуллерен
Аморфный углерод
Описание слайда:
Алмаз
Самое твердое вещество, найденное в природе.
• Бесцветен, хотя встречаются и окрашенные образцы
• Кристаллы сильно преломляют свет.
• Не проводит электрический ток.
Описание слайда:
Применяют его в ювелирной промышленности, изготовлении буров, сверл, резки стекла.
Описание слайда:
Графит
• Мягок, легко расслаивается на отдельные чешуйки.
• Непрозрачен, серого цвета, обладает металлическим блеском.
• Тугоплавок.
• Проводит электрический ток.
Описание слайда:
Применение графита
Применяют для изготовления электродов, твердой смазки, стержней карандашей.
Описание слайда:
Карбин
Порошок черного цвета.
• По твердости занимает промежуточное положение между алмазом и графитом.
• Обладает полупроводниковыми свойствами.
Описание слайда:
Применение карбина
Карбин уже нашел применение в электронике, космонавтике, авиации и медицине. Перспективно его применение в оптике, микроволновой и электрической технологиях, в конструкциях источников тока и прочее. Во всех этих областях ключевое значение имеет высокая стабильность материала.
Описание слайда:
Фуллерен
Фуллерен является новой аллотропной формой углерода. Молекулы фуллерена состоят из 60,70 атомов, образующих сферу. Кристаллические фуллерены представляют собой полупроводники.
Описание слайда:
Применение фуллерена
Фуллерены используют :
Для создания фотоприемников;
Оптоэлектронных устройств;
Сверхпроводящих материалов;
В качестве красителей для копировальных машин;
В качестве основы для создания аккумуляторных батарей.
Описание слайда:
Описание слайда:
Применение аморфного углерода
Сажа используется при изготовлении типографской краски, картриджей, косметической туши;
Кокс используется в доменных печах при выплавке стали и чугуна;
Древесный уголь применяется в качестве топлива;
Активированный уголь применяется как на этапе оказания первой помощи отравившемуся человеку, так и во время последующего лечения и восстановления организма.
Описание слайда:
Причины аллотропии углерода
• Самый маленький атом в группе.
• Атом с самой высокой валентностью среди элементов своего периода.
• Большая электронная плотность на валентных орбиталях.
Описание слайда:
Вывод:
Углерод и его аллотропные модификации имеют большое практическое значение в жизни человека и промышленности. Если аллотропные модификации углерода (алмаз, графит) были изучены уже давно, то, например, фуллерен (1985) до конца еще не исследован, но нашел широкое применение в оптоэлектронике, микроэлектронике, в производстве полевых транзисторов и других областях советской техники.
Описание слайда:
Спасибо за внимание.
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
Курс повышения квалификации
Современные педтехнологии в деятельности учителя
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
Ищем педагогов в команду «Инфоурок»
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
также Вы можете выбрать тип материала:
Краткое описание документа:
Область соединений углерода так велика, что составляет особую отрасль химии, т. е. химии углеродистых, или, лучше, углеводородных, соединений. Д. И. Менделеев, «Основы химии». Аллотропия – это явление существования двух и более простых веществ одного и того же химического элемента, но различных по своему строению и соответственно свойствам. Все формы и модификации таких веществ называют аллотропными. Об том идет речь в нашей презентации.
Общая информация
Похожие материалы
Презентация по химии «Сплавы»
Контрольная работа по теме: «Неметаллы и их соединения»
Контрольная работа по химии. Раздел «Первоначальные химические понятия»
КТП по химии для СПО
Фонд оценочных средств по дисциплине ЕН.02 Экологические основы природопользования
Практическая работа №1 по биологии на тему «Изучение хромосом (на фиксированных микропрепаратах, микрофотографиях)
Рабочая программа по химии для СПО
Сценарий урока химии по теме «Спирты»(10 класс)
Не нашли то что искали?
Воспользуйтесь поиском по нашей базе из
5403738 материалов.
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
В России утвердили новый порядок формирования федерального перечня учебников
Время чтения: 1 минута
В МГУ заработала университетская квантовая сеть
Время чтения: 1 минута
Росприроднадзор призвал ввести в школах курс по экологии
Время чтения: 1 минута
Учителям предлагают 1,5 миллиона рублей за переезд в Златоуст
Время чтения: 1 минута
Путин поручил не считать выплаты за классное руководство в средней зарплате
Время чтения: 1 минута
В Петербурге школьникам разрешили уйти на каникулы с 25 декабря
Время чтения: 2 минуты
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.