Что не взаимодействует с серной кислотой концентрированной
Серная кислота
Обладает выраженным дегидратационным (водоотнимающим) действием. При попадании на кожу или слизистые оболочки приводит к тяжелым ожогам.
Получение
Известны несколько способов получения серной кислоты. Применяется промышленный (контактный) способ, основанный на сжигании пирита, окислении образовавшегося SO2 до SO3 и последующим взаимодействием с водой.
Нитрозный способ получения основан на взаимодействии сернистого газа с диоксидом азота IV в присутствии воды. Он состоит из нескольких этапов:
В окислительной башне смешивают оксиды азота (II) и (IV) с воздухом:
Смесь газов подается в башни, орошаемые 75-ной% серной кислотой, здесь смесь оксидов азота поглощается с образованием нитрозилсерной кислоты:
В ходе гидролиза нитрозилсерной кислоты получают азотистую кислоту и серную:
В упрощенном виде нитрозный способ можно записать так:
Химические свойства
В водном растворе диссоциирует ступенчато.
С солями реакция идет, если в результате выпадает осадок, образуется газ или слабый электролит (вода). Серная кислота, как и многие другие кислоты, способна растворять осадки.
Подчеркну, что реакции разбавленной серной кислоты с железом и хромом не сопровождаются переходом этих элементов в максимальную степень окисления. Они окисляются до +2.
Cu + H2SO4(разб.) ⇸ (реакция не идет, медь не может вытеснить водород из кислоты)
Холодная концентрированная серная кислота пассивирует Al, Cr, Fe, Ni, Be, Co. При нагревании или амальгамировании данных металлов реакция идет.
Обратите особое внимание, что при реакции железа, хрома с концентрированной серной кислотой достигается степень окисления +3. В подобных реакциях с разбавленной серной кислотой (написаны выше) достигается степень окисления +2.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Что не взаимодействует с серной кислотой концентрированной
ОТНОШЕНИЕ МЕТАЛЛОВ К КИСЛОТАМ
Образующиеся в этом процессе ионы водорода H + выполняют роль окислителя, окисляя металлы, расположенные в ряду активности левее водорода. Взаимодействие протекает по схеме:
Me + HCl 
Соляная кислота является слабым окислителем, поэтому металлы с переменной валентностью окисляются ей до низших положительных степеней окисления:
2 Al + 6 HCl → 2 AlCl 3 + 3 H 2 ↑
Соляная кислота пассивирует свинец ( Pb ). Пассивация свинца обусловлена образованием на его поверхности трудно растворимого в воде хлорида свинца ( II ), который защищает металл от дальнейшего воздействия кислоты:
В промышленности получают серную кислоту очень высокой концентрации (до 98%). Следует учитывать различие окислительных свойств разбавленного раствора и концентрированной серной кислоты по отношению к металлам.
Разбавленная серная кислота
В разбавленном водном растворе серной кислоты большинство ее молекул диссоциируют:
Образующиеся ионы Н + выполняют функцию окислителя.
Как и соляная кислота, разбавленный раствор серной кислоты взаимодействует только с металлами активными и средней активности (расположенными в ряду активности до водорода).
Химическая реакция протекает по схеме:
Металлы с переменной валентностью окисляются разбавленным раствором серной кислоты до низших положительных степеней окисления:
Концентрированная серная кислота
В концентрированном растворе серной кислоты (выше 68%) большинство молекул находятся в недиссоциированном состоянии, поэтому функцию окислителя выполняет сера, находящаяся в высшей степени окисления ( S +6 ). Концентрированная H 2 SO 4 окисляет все металлы, стандартный электродный потенциал которых меньше потенциала окислителя – сульфат-иона SO 4 2- (0,36 В). В связи с этим, с концентрированной серной кислотой реагируют и некоторые малоактивные металлы.
Процесс взаимодействия металлов с концентрированной серной кислотой в большинстве случаев протекает по схеме:
Me + H 2 SO 4 (конц.) 
Продуктами восстановления серной кислоты могут быть следующие соединения серы:
Взаимодействие металлов различной активности с концентрированной серной кислотой можно представить схемой:
Концентрированная серная кислота является сильным окислителем, поэтому при взаимодействии с ней металлов, обладающих переменной валентностью, последние окисляются до более высоких степеней окисления, чем в случае с разбавленным раствором кислоты:
Серная кислота — химические свойства и промышленное производство

Тяжелая маслянистая жидкость («купоросное масло»);
плотность 1,84 г/см3; нелетучая, хорошо растворима в воде – с сильным нагревом; t°пл. = 10,3°C, t°кип. = 296°С, очень гигроскопична, обладает водоотнимающими свойствами (обугливание бумаги, дерева, сахара).
Теплота гидратации настолько велика, что смесь может вскипать, разбрызгиваться и вызывать ожоги. Поэтому необходимо добавлять кислоту к воде, а не наоборот, поскольку при добавлении воды к кислоте более легкая вода окажется на поверхности кислоты, где и сосредоточится вся выделяющаяся теплота.
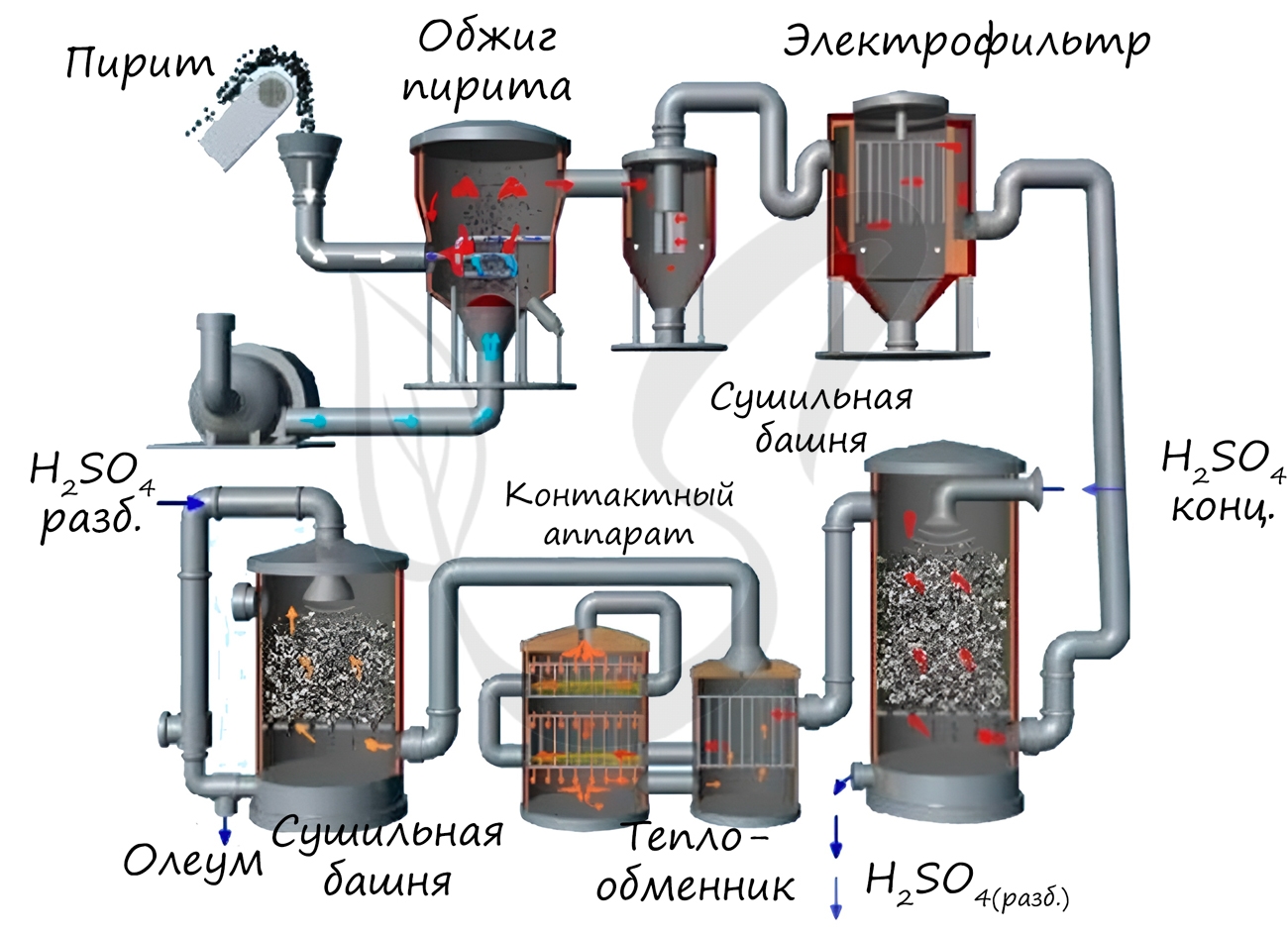
Промышленное производство серной кислоты (контактный способ):

Измельчённый очищенный влажный пирит (серный колчедан) сверху засыпают в печь для обжига в «кипящем слое«. Снизу (принцип противотока) пропускают воздух, обогащённый кислородом.
Из печи выходит печной газ, состав которого: SO2, O2, пары воды (пирит был влажный) и мельчайшие частицы огарка (оксида железа). Газ очищают от примесей твёрдых частиц (в циклоне и электрофильтре) и паров воды (в сушильной башне).
В контактном аппарате происходит окисление сернистого газа с использованием катализатора V 2 O 5 ( пятиокись ванадия) для увеличения скорости реакции. Процесс окисления одного оксида в другой является обратимым. Поэтому подбирают оптимальные условия протекания прямой реакции — повышенное давление (т.к прямая реакция идет с уменьшением общего объема) и температура не выше 500 С ( т.к реакция экзотермическая).
В поглотительной башне происходит поглощение оксида серы (VI) концентрированной серной кислотой.
Поглощение водой не используют, т.к оксид серы растворяется в воде с выделением большого количества теплоты, поэтому образующаяся серная кислота закипает и превращается в пар. Для того, чтобы не образовывалось сернокислотного тумана, используют 98%-ную концентрированную серную кислоту. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H2SO4·nSO3
Химические свойства серной кислоты:
H2SO4 — сильная двухосновная кислота, одна из самых сильных минеральных кислот, из-за высокой полярности связь Н – О легко разрывается.
2) Взаимодействие серной кислоты с металлами:
Разбавленная серная кислота растворяет только металлы, стоящие в ряду напряжений левее водорода:
Zn 0 + H2 +1 SO4(разб) → Zn +2 SO4 + H2
3) Взаимодействие серной кислоты с основными оксидами:
CuO + H2SO4 → CuSO4 + H2O
5) Обменные реакции с солями:
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
Образование белого осадка BaSO4 (нерастворимого в кислотах) используется для обнаружения серной кислоты и растворимых сульфатов (качественная реакция на сульфат ион).
Особые свойства концентрированной H2SO4 :
Активный металл
8 Al + 15 H2SO4(конц.)→4Al2(SO4)3 + 12H2O + 3 H2S
4│2Al 0 – 6e — → 2Al 3+ — окисление
3│ S 6+ + 8e → S 2– восстановление
Металл средней активности
2Cr + 4 H2SO4(конц.)→ Cr2(SO4)3 + 4 H2O + S
1│ 2Cr 0 – 6e →2Cr 3+ — окисление
1│ S 6+ + 6e → S 0 – восстановление
Металл малоактивный
2Bi + 6H2SO4(конц.)→ Bi2(SO4)3 + 6H2O + 3 SO2
1│ 2Bi 0 – 6e → 2Bi 3+ – окисление
3│ S 6+ + 2e →S 4+ — восстановление
2) Концентрированная серная кислота окисляет некоторые неметаллы как правило до максимальной степени окисления, сама восстанавливается до S +4 O2:
3) Окисление сложных веществ:
Серная кислота окисляет HI и НВг до свободных галогенов:
2 КВr + 2Н2SO4 = К2SО4 + SO2 + Вr2 + 2Н2О
2 КI + 2Н2SО4 = К2SO4 + SO2 + I2 + 2Н2О
Концентрированная серная кислота не может окислить хлорид-ионы до свободного хлора, что дает возможность получать НСl по реакции обмена:
NаСl + Н2SO4(конц.) = NаНSO4 + НСl
Серная кислота отнимает химически связанную воду от органических соединений, содержащих гидроксильные группы. Дегидратация этилового спирта в присутствии концентрированной серной кислоты приводит к получению этилена:
С2Н5ОН = С2Н4 + Н2О.
Обугливание сахара, целлюлозы, крахмала и др. углеводов при контакте с серной кислотой объясняется также их обезвоживанием:
C6H12O6 + 12H2SO4 = 18H2O + 12SO2↑ + 6CO2↑.
Химия, Биология, подготовка к ГИА и ЕГЭ
ОВР в статье специально выделены цветом. Обратите на них особое внимание. Эти уравнения могут попасться в ЕГЭ.
Разбавленная серная ведет себя, как и остальные кислоты, окислительные свои возможности прячет:
Zn + H2SO4 → ZnSO4 + H2↑
Автор статьи — Саид Лутфуллин
Окислительные свойства серной кислоты
Концентрированная серная кислота – тяжелая маслянистая жидкость, не летучая, не имеет вкуса и запаха
За счет серы в степени окисления +6(высшей) серная кислота приобретает сильные окислительные свойства.
Правило для задания 24 (по-старому А24) при приготовлении растворов серной кислоты никогда нельзя в нее лить воду. Концентрированую серную кислоту нужно тонкой струйкой вливать в воду, постоянно помешивая.
Взаимодействие концентрированной серной кислоты с металлами
Эти реакции строго стандартизированны и идут по схеме:
H2SO4(конц.) + металл → сульфат металла + H2O + продукт восстановленной серы.
1) Алюминий, железо и хром с H2SO4 (конц) в нормальных условиях не реагируют, из-за пассивации. Нужно нагреть.
2) С платиной и золотом H2SO4 (конц) не реагирует вообще.
Сера в концентрированной серной кислоте – окислитель
Рассмотрим диаграмму степеней окисления серы:
Реакции будут идти вот так:
(обратите внимание, что железо окисляется до +3, до максимально возможной, высшей степени окисления, так как оно имеет дело с сильным окислителем)
Конечно, все относительно. Глубина восстановления будет зависеть от многих факторов: концентрации кислоты (90%, 80%, 60%), температуры и т.д. Поэтому совсем уж точно предсказать продукты нельзя. Приведенная выше таблица тоже имеет свой процент приблизительности, но пользоваться ей можно. Еще необходимо помнить, что в ЕГЭ, когда продукт восстановленной серы не указан, и металл не отличается особой активностью, то, скорее всего, составители имеют в виду SO 2. Нужно смотреть по ситуации и искать зацепки в условиях.
SO 2 – это вообще частый продукт ОВР с участием конц. серной кислоты.
H2SO4 (конц) окисляет некоторые неметаллы (которые проявляют восстановительные свойства), как правило, до максимальной — высшей степени окисления (образуется оксид этого неметалла). Сера при этом тоже восстанавливается до SO 2:
Свежеобразованный оксид фосфора ( V ) реагирует с водой, получается ортофосфорная кислота. Поэтому реакцию записывают сразу:
То же самое с бором, он превращается в ортоборную кислоту:
Очень интересны взаимодействие серы со степенью окисления +6 (в серной кислоте) с «другой» серой (находящейся в другом соединении). В рамках ЕГЭ рассматривается взаимодействиеH2SO4 (конц) с серой (простым веществом) и сероводородом.
Начнем с взаимодействия серы (простого вещества) с концентрированной серной кислотой. В простом веществе степень окисления 0, в кислоте +6. В этой ОВР сера +6 будет окислять серу 0. Посмотрим на диаграмму степеней окисления серы:
Сера 0 будет окисляться, а сера +6 будет восстанавливаться, то есть понижать степень окисления. Будет выделяться сернистый газ:
Но в случае с сероводородом:
Образуется и сера (простое вещество), и сернистый газ:
Этот принцип часто может помочь в определении продукта ОВР, где окислитель и восстановитель – один и тот же элемент, в разных степенях окисления. Окислитель и восстановитель «идут навстречу друг другу» по диаграмме степеней окисления.
А вот галогены в составе бромидов и иодидов (как и в составе соответствующих галогеноводородов) окисляются ей до свободных галогенов. Только вот сера восстанавливается по-разному: иодид является более cильным восстановителем, чем бромид. Поэтому иодид восстанавливает серу до сероводорода, а бромид до сернистого газа:
Хлороводород и фтороводород (как и их соли) устойчивы к окисляющему действию H2SO4 (конц).
Это позволяет использовать концентрированную серную кислоту самым разным образом:
Во-первых, осушение веществ. Концентрированная серная кислота забирает воду от вещества и оно «становится сухим».
Во-вторых, катализатор в реакциях, в которых отщепляется вода (например, дегидратация и этерификация):
Взаимодействие серной кислоты с металлами и неметаллами
Общее описание
Серная кислота является токсичным реагентом, который отличается специфичностью применения и высоким показателем опасности для живого организма. Эта жидкость характеризуется как сильный окислитель. Температура плавления H2SO4 составляет +10 °C. Закипает кислота при +296 °C. В результате выделяется вода и оксид серы SO3. Так как эта жидкость способна поглощать пары воды, её часто используют для осушения газов. Добывают серу промышленным путём, используя для этого диоксид серы SO2, который можно получить только в результате горения серы либо серного колчедана.
Под воздействием низких температур H2SO4 пассивирует некоторые металлы, например алюминий, железо, хром, никель, титан. Благодаря этому транспортировать кислоту можно в герметичных железных цистернах.
Добыть H2SO4 можно двумя способами:
Присутствующий в кислоте раствор SO3 называется олеумом, который также используют для получения H2SO4. Реакция на металлы и неметаллы всегда отличается. При использовании двухосновной маслянистой жидкости образуется 2 вида солей: средние — сульфаты (барий, кальций), кислые — гидросульфаты (натрий, калий).
Этапы производства
Изготовление кислоты является довольно интересным и познавательным процессом. Изначально серный колчедан (измельчённый влажный пирит) засыпают в специальную печь для обжига. В нижней части оборудования пускают воздух, который специально обогащают кислородом. Постепенно из печи начинает выходить газ, в состав которого входят: SO2, O2, микроскопические частицы огарка (оксида железа) и пары воды (использовался влажный пирит). С помощью электрофильтра и циклона газ очищают от примесей твёрдых частиц. Сушильная башня удаляет все пары воды.
Окисление полученного серного газа происходит благодаря катализатору V2O5 в контактном аппарате. Такой подход позволяет ускорить химическую реакцию. Процесс окисления одного оксида в другой на практике является обратным. Специалисты стараются создать оптимальные условия, чтобы добиться протекания прямой реакции — повышенное давление и температура от +500 °C. Всё это позволяет получить необходимую экзотермическую реакцию.
В специальной башне поглощается оксид серы концентрированной кислоты. Приём с водой не используют, так как оксид серы легко растворяется с выделением большого количества теплоты, из-за чего жидкость закипает и превращается в пар. Избежать сернокислотного тумана помогает H2SO4 в концентрации 98%. Оксид серы хорошо растворяется и образует олеум: H2SO4*nSO3.
Использование H2SO4 в разбавленном виде
Серная кислота имеет одну особенность — она может отнимать воду, из-за чего её часто используют как надёжное гигроскопическое средство во многих химических реакциях. С помощью этой жидкости можно получать органические вещества, провести осушку, а также снизить вероятность поглощения воды конкретными элементами. Для решения всех этих задач в лабораторных условиях используются специальные герметические ёмкости, которые называются эксикаторами.
Востребованность H2SO4 никогда не уменьшается, так как она имеет широкую сферу применения. Концентрированная жидкость может обугливать органические вещества (например, древесину), а также вызывать сильные ожоги кожного покрова. Если для проведения химических экспериментов нужно использовать кислоту, тогда должны быть соблюдены все правила безопасности. Если капля разбавленной жидкости H2SO4 попала на кожу либо одежду, то по мере испарения воды она постепенно будет увеличивать свою концентрацию.
Разбавленная кислота может вступать в реакцию замещения, что спровоцировано окислением катионов. По этой причине на все активные металлы, которые находятся до водорода в ряду напряжений, H2SO4 реагирует как обычная кислота. Постепенно происходит вытеснение водорода. Этот эффект подробно объясняют на уроках химии в 8 классе. С разбавленной серной кислотой не взаимодействуют благородные металлы (например, золото, платина) и те элементы, которые стоят после водорода в ряду напряжения. Другими окислительными свойствами разбавленная маслянистая жидкость H2SO4 не обладает.
Лабораторные исследования подтвердили, что кислота реагирует на основные оксиды и основания, из-за чего образуется сразу 2 ряда солей: кислые — гидросульфаты, средние — сульфаты. К качественным реакциям на H2SO4 можно отнести взаимодействие с солями бария, в результате чего образуется белый осадок, который не растворяется в воде и кислой среде. Эту химическую реакцию можно изобразить с помощью формулы: H2SO4 + BaCl 2 = BaSO 4↓ + 2HCl.
Свойства концентрированной кислоты
В концентрированном виде жидкость H2SO4 способна максимально проявить свои окислительные свойства. Это вызвано тем, что в молекулах кислоты находятся атомы серы в высшей степени окисления (+6). В концентрированном виде H2SO4 взаимодействует с металлами, которые находятся в электрохимическом ряду напряжения (правее водорода). Речь касается серебра, ртути и меди. В результате химической реакции образуется вода, сульфаты и продукты восстановления серы. Степень восстановления кислоты зависит от металлов. Например:
В концентрированном виде H2SO4 не вступает в реакцию с платиной и золотом, так как эти металлы обладают небольшой активностью. Если речь касается хрома, алюминия и железа, тогда понадобится нагревание. В противном случае реакция не произойдёт, что связано с пассивированием этих металлов (на поверхности образуется тонкая защитная плёнка).
Продукт восстановления кислоты всецело зависит от концентрации H2SO4 и активности используемого металла. Каждая химическая реакция должна быть рассмотрена индивидуально. Алюминий, хром и железо могут растворяться в концентрированной кислоте, но при условии сильного нагревания. В результате образуется соль металла и продукты восстановления серной кислоты. Формулы выглядят следующим образом:
Совершенно другую реакцию можно наблюдать в том случае, если нужно проверить взаимодействие кислоты с металлами. Происходит выделение SO2 и окисление неметаллов до высшей степени. Например:
В разбавленном виде кислота ничем не отличается от других похожих жидкостей. В категорию исключений входит только то, что H2SO4 не вступает в реакцию со свинцом, так как образовавшийся сульфат свинца невозможно растворить.
Токсичность и сферы применения
Серная кислота и олеум относятся к категории наиболее едких веществ. Они могут обжечь кожу, слизистые оболочки и дыхательные пути. Из-за неаккуратного обращения с агрессивной жидкостью не исключено возникновение химического ожога. Вдыхание паров этих веществ может спровоцировать кашель, затруднённое дыхание, бронхит. В атмосфере может образовываться аэрозоль из-за ядовитого дыма металлургических и химических производств. В такой ситуации могут выпадать кислотные дожди.
При правильном применении H2SO4 может пригодиться в следующих случаях:
Во всём мире в год используется до 160 тонн кислоты. Больше всего эту жидкость применяют в производстве минеральных удобрений. По этой причине сернокислотные заводы стараются возводить вместе с предприятиями, которые будут заниматься изготовлением удобрений.
Не менее востребованными являются соли серной кислоты. Мирабилит (Nа2SO4•10Н2O) был получен немецким химиком И. Глаубером, который экспериментировал с тем, как действует H2SO4 на хлорид натрия. В медицинской практике это средство используется в качестве слабительного.
Спрос также получил железный купорос (FeSO4*7H2O), который ранее применяли для лечения диагностированной чесотки. Но в настоящее время этот химический компонент используется только для борьбы с сельскохозяйственными вредителями. Применение большой концентрации железного купороса чревато гибелью обработанной культуры. Медный купорос (CuSO4*5H2O) получил большой спрос в сельском хозяйстве для борьбы с вредителями растений.