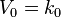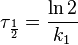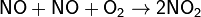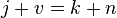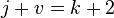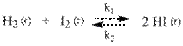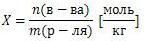Что называют порядком химической реакции
Порядок химической реакции



Порядок реакции по данному веществу — показатель степени при концентрации этого вещества в кинетическом уравнении реакции.
Реакция нулевого порядка
Кинетическое уравнение имеет следующий вид:
Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ. Нулевой порядок характерен, например, для гетерогенных реакций в том случае, если скорость диффузии реагентов к поверхности раздела фаз меньше скорости их химического превращения.
Реакция первого порядка
Кинетическое уравнение реакции первого порядка:
Приведение уравнения к линейному виду даёт уравнение:
Константа скорости реакции вычисляется как тангенс угла наклона прямой к оси времени:
Реакция второго порядка
Для реакций второго порядка кинетическое уравнение имеет следующий вид:
Молекулярность элементарной реакции — число частиц, которые, согласно экспериментально установленному механизму реакции, участвуют в элементарном акте химического взаимодействия.
Мономолекулярные реакции — реакции, в которых происходит химическое превращение одной молекулы (изомеризация, диссоциация и т. д.):
Бимолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении двух частиц (одинаковых или различных):
Тримолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении трех частиц:
Реакции с молекулярностью более трёх неизвестны.
Для элементарных реакций, проводимых при близких концентрациях исходных веществ, величины молекулярности и порядка реакции совпадают. Чётко определенной взаимосвязи между понятиями молекулярности и порядка реакции нет, так как порядок реакции характеризует кинетическое уравнение реакции, а молекулярность — механизм реакции.
Вопрос 4. Коагуляция смесью электролитов. Аддитивность, Антагонизм, Синергизм.
Первая количественная теория коагуляции смесями электролитов была развита Ю. М. Глазманом на основе современной физической теории коагуляции лиофобных золей. Согласно этой теории антагонизм ионов (а также противоположный эффект — синергизм) для сильно заряженных золей есть следствие электростатических взаимодействий в диффузных атмосферах коллоидных частиц, а для слабо заряженных золей может обусловливаться конкуренцией ионов за места в адсорбционном слое. В ряде случаев на коагулирующее действие смеси электролитов может влиять химическое взаимодействие между их ионами, ведущее к образованию не обладающих коагулирующим действием комплексов или нерастворимых соединений. Примером может служить коагуляция золя Agl смесью электролитов K2SO4 и Th(N03)4r образующих комплекс К2 [Th(S04)3], в котором теряет свою коагулирующую силу.
Аддитивность. Если смешать два совершенных (трудно сжижаемых, имеющих низкую критическую температуру) газа, то объём смеси окажется почти математически точно равным сумме объёмов смешанных газов; точно так же не изменятся при смешении их светопреломляющая способность, удельная теплоёмкость и т. д., и эти свойства такой смеси могут быть вычислены на основании свойств смешиваемых тел. Не то наблюдается, когда смешиваются между собою жидкости: сумма их объёмов обыкновенно не равна (больше, меньше) объёму смеси и т. д.; но иногда и здесь оказывается возможным вычислить (с достаточной степенью приближения к опытным данным) некоторые свойства смеси из свойств слагаемых, руководствуясь только правилом смешения и предполагая, что эти свойства при смешении не меняются. Подобные свойства называются, согласно предложению Оствальда, аддитивными.
Синергизм — это такая ответная реакция организма на сочетание двух или нескольких агентов, когда эффект данного сочетания превышает сумму эффектов всех компонентов. Различают два вида синергизма — аддитивный и потенцированный или истинный. При аддитивном синергизме конечный эффект сочетания равен сумме эффектов компонентов его составляющих. Надо иметь в виду, что в этом случае агенты действуют в одном направлении, на одни и те же биологические структуры и процессы. При истинном синергизме или потенцировании конечный эффект превышает сумму эффектов компонентов, причем агенты вызывают одинаковый конечный эффект, взаимодействуя не с одними и теми же структурами и процессами, а с различными.
Антагонизм — явление, характеризующееся полным угнетением или ослаблением эффекта одного вещества другим. Обычно считается, что антагонизм имеет место в тех случаях, когда применение двух веществ дает меньший эффект, чем можно было ожидать на основании индивидуального действия каждого из них. Различают физико-химический, или прямой и физиологический, или непрямой антагонизм. Физико-химический антагонизм может наблюдаться непосредственно между веществами в кормовой смеси при приготовлении и хранении ее. При этом вещества (особенно минеральные и различные синтетические), одновременно находящиеся в комбикормах, взаимно подавляют или ослабляют присущие каждому из них действие, свойство. При антагонизме физиологическом ингредиенты комбикормов взаимодействуют через функциональные системы и биохимические процессы животного организма в результате угнетения определенных функций. Если действие веществ взаимно ослабевает, то такой антагонизм называют двусторонним, если же действие одного вещества угнетается, а другого нет, то это антагонизм односторонний. Различают также антагонизм конкурентный и неконкурентный. При конкурентном антагонизме вещества на одну и ту же систему организма влияют противоположно, а при неконкурентном — они проявляют свое антагонистическое действие на различные системы.
Билет №29
1. Записать выражение 
2. Полярограмма- физический смысл, графическое изображение, ее характеристики.
Вольтамперометрия (полярограмма) — это группа электрохимических методов анализа, в основе которых лежит электролиз анализируемого компонента (электровосстановление или электроокисление) в специальных условиях с последующим изучением полученной при этом зависимости силы тока, протекающего через электродную ячейку, от приложенного к ней напряжения.
Электродная ячейка в вольтамперометрии содержит два электрода с сильно различающимися размерами поверхностей. Рабочий электрод, на котором происходят процессы окисления или восстановления, называется микроэлектродом и имеет весьма малую поверхность £
0,01. 0,03 см2. Второй электрод имеет поверхность £ в сотни раз большую и называется макроэлектродом. При прохождении тока I через ячейку его плотность на микроэлектроде, то есть отношение 1/5, в сотни раз больше, чем на макроэлектроде. Поэтому микроэлектрод сильно поляризуется, на нем с большой скоростью протекают процессы электровосстановления или электроокисления. Из-за малой плотности тока на макроэлектроде он не поляризуется, и его потенциал остается постоянным. Это первое условие электролиза в вольтамперометрии; второе условие электролиза — непрерывное повышение напряжения на ячейке с определенной скоростью, но не более 200 мВ/мин.
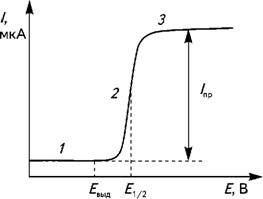
Графическая зависимость между напряжением и силой тока получила название вольтамперометрической кривой, или поля-рограммы. Типичный вид ее представлен на рис.1. Участок 1 на полярограмме называется остаточным током. Его величина имеет порядок 10-7 А и обусловлена процессами восстановления следов примесей в растворе, в том числе и растворенного кислорода, а также током заряжения, или конденсаторным током. Образование тока заряжения связано с тем, что при снятии полярограммы между поверхностью микроэлектрода и раствором образуется оболочка из невосстанавливающихся ионов фонового электролита. Эта система ведет себя как конденсатор. При заряжении такого конденсатора и возникает ток заряжения. Участок 2 на полярограмме — это участок диффузионного тока, а участок 3 — участок предельного диффузионного тока. Его значение определяется концентрацией восстанавливаемого катиона. Величина Евыд соответствует потенциалу выделения катиона, после которого начинает возрастать диффузионный ток при росте Е.
Потенциал Е1/2 называется потенциалом полуволны. Его величина не зависит от концентрации анализируемого компонента, а определяется только его природой.
Рис. 1. Вольтамперометрическая кривая (полярограмма)
Вопрос 3. Правило фаз Гиббса. Дать понятие фазы, компонента и степени свободы.
Пра́вило фаз (или правило фаз Гиббса) — соотношение, связывающее число веществ (компонентов), фаз и степеней свободы в гетерогенной системе. Правило фаз записывается следующим образом:
где j — число фаз (например, агрегатных состояний вещества);
v — числостепеней свободы, то есть независимых параметров (температура, давление, концентрация компонентов), которые полностью определяют состояние системы при равновесии и которые можно менять без изменения числа и природы фаз;
k — числокомпонентовсистемы — число входящих в систему индивидуальных веществ за вычетом числа химических уравнений, связывающих эти вещества. Иначе говоря, это минимальное количество веществ, из которых можно приготовить каждую фазу системы.
n — число переменных, характеризующих влияние внешних условий на равновесие системы.
При переменных давлении и температуре правило фаз сводится к выражению:
В случае однокомпонентной системы оно упрощается до:
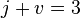
Отсюда видно, например, что в однокомпонентной системе три фазы (j=3) могут сосуществовать при числе степеней свободы v, равном нулю, то есть при фиксированных давлении и температуре, что соответствует тройной точке на фазовой диаграмме. Две фазы (j=2) сосуществуют при произвольном измененнии либо давления, либо температуры, когда вторая из этих переменных не является независимой (v=1), то есть двухфазному равновесию на фазовой диаграмме соответствует линия. Если фаза одна (j=1), число степеней свободы системы равно двум, то есть температура и давление могут менятся независимо в пределах некоторой области на фазовой диаграмме — пока система не окажется на одной из линий двухфазного равновесия.
Иногда правило фаз записывают следующим образом:
то есть при равновесии число фаз в системе меньше либо равно числу компонентов плюс 2.
Коагуляция — это процесс уменьшения степени дисперсности и числа частиц дисперсной системы путем слипания первичных частиц. В результате коагуляции обычно происходит выпадение (седиментация) дисперсной фазы или хотя бы изменение свойств первичной дисперсной системы. Коагуляционные структуры образуются при потере дисперсной системой агрегативной устойчивости, при достаточном содержании дисперсной фазы обеспечивается армирование всего объема дисперсной системы. Соответствующее содержание коллоидно-дисперсной фазы, способное «отверждать» жидкую дисперсионную среду, может быть очень малым (особенно в случае резко анизометрических частиц), например всего лишь несколько процентов по массе для бентонитовых глин, и еще значительно меньше для нитевидных частиц.
Ге́ли (ед.ч. гель, от лат. gelo — «застываю») — структурированные системы, состоящие из высокомолекулярных и низкомолекулярных веществ. Наличие трёхмерного полимерного каркаса (сетки) сообщает гелям механические свойства твёрдых тел (отсутствие текучести, способность сохранять форму, прочность и способность к деформации (пластичность и упругость). Гели состоят, по крайней мере, из двух компонентов, один из которых образует непрерывную трёхмерную макромолекулярную сетку, выступающую в роли каркаса, пустоты в которой заполнены низкомолекулярным растворителем — дисперсионной средой.
Студни — структурированные гомогенные системы, заполненные жидкостью, каркас которых образован молекулами высокомолекулярных соединений. В современной науке о полимерах оба термина — «студни» и «гели» — используются как синонимы, так как многие свойства студней и коллоидных гелей схожи. Студни похожи по свойствам на коллоидные гели, в частности характеризуются отсутствием текучести, способностью сохранять форму, прочностью и упругостью. Эти свойства обусловлены наличием пронизывающей весь объём студня пространственной сетки макромолекул.
Тиксотропия (тиксотропность) — способность субстанции уменьшать вязкость (разжижаться) от механического воздействия и увеличивать вязкость (сгущаться) в состоянии покоя. Примерами типичных тиксотропных структурмогут служить системы, образующиеся при коагуляции водных коллоидных дисперсий гидроокиси железа,гидроокиси алюминия, пятиокиси ванадия, суспензий бентонита, каолина.
СИНЕРЕЗИС — выделение жидкой фазы из дисперсной структуры (геля),сопровождающееся уменьшением объема. Происходит в водонасыщенных тонкодисперсных (глинистых)осадках в стадию диагенеза, представляя собой постепенное самоуплотнение пространственной структурыпод действием сцепления между коллоид. и субколлоид. частицами (“старение” дисперсной системы) илипод тяжестью вышележащих осадков. Сопровождается механическим вытеснением иловой воды иувеличением жесткости осадка.
Билет 30
Вопрос 1) Светофильтра ми называются среды, способные пропускать лишь определенные области спектра. Обычно в фотоколориметрах используются в качестве светофильтров стекла. Зная максимум поглощения вещества, можно выбрать такой светофильтр, который пропускал бы только лучи, поглощаемые раствором, и задерживал бы все остальные, где максимум пропускания светофильтра совпадает с максимумом поглощения раствора. Чаще всего удается только приблизительно выделить при помощи светофильтра нужную область спектра.
Вопрос 2)14Cr+Cr2O7=2Cr+7H2O
Вопрос 3)Рефракция молярная (R) (от позднелат. refractio-преломление), произведение уд. рефракции г да мол. массу М: R = rМ. Уд. рефракция представляет собой отношение некоторой ф-ции f(n) показателя преломления л (см.Рефрактометрия) к плотности r вещества: r =f(n)/r. Величина г практически не зависит от температуры, давления и агрегатного состояния вещества. Из мн. предлагавшихся ф-ций f(n) наиб. распространение получила ф-ция Лоренца-Лоренца: f(n) = (n 2 — 1)/(n 2 + + 2).
Молярная рефракция зависит от состава и структуры вещества и обладает свойством аддитивности, т.е. может быть представлена в виде суммы: R = SxkRk. В случае растворов xk—молярная доля k-гo компонента раствора с P.M. Rk; в случае хим. соединений xk—число фрагментов k-го вида с присущими им постоянными значениями Rk. Такими фрагментами м. б. ионы. атомы или атомные группировки; соответствующие им Rk называют ионными, атомными или групповыми рефракциями. Атомы одного элемента, но находящиеся в разных валентных состояниях или в разных функц. группах, имеют разл. значения Rk. Иногда необходимо вводить дополнит. слагаемые-инкременты рефракции циклов, двойных и тройных связей. например, инкременты связей С=С, С=С, трехчленного и четырехчленного углеродных циклов составляют соотв. 1,733, 2,398, 0,71 и 0,5.
Вопрос 4)СТРУКТУРООБРАЗОВАНИЕ в дисперсных системах, самопроизвольное соединение частиц дисперсной фазы и их агрегатов в пространств. структуры. Наблюдается в системах с твердой дисперсной фазой и жидкой или газовойдисперсионной средой (суспензии, золи, латексы, биол. системы, порошки и т.п.), в концентрир. эмульсиях, в т.ч. стабилизированных микроэмульсиями пенах.
Билет31
Вопрос 2)РЭЛЕЯ УРАВНЕНИЕ
— нелинейное обыкновенное дифференциальное уравнение 2-го порядка

Р. у. описывает типичную нелинейную систему с одной степенью свободы, в к-рой возможныавтоколебания.
Вопрос 3)Сложные реакциитакие Реакции химические, элементарные акты которых различны.С. р. можно рассматривать как совокупность простых реакций,которые в этом случае называются стадиями сложной реакции. Параллельные реакции. 1) N2O → N2 + O 2
Обрати́мые реа́кции — химические реакции, протекающие одновременно в двух противоположных направлениях (прямом и обратном), например:
химические процессы, в которых продукт одной реакции является исходным веществом др. реакции. КП. р. относятся такие важные химические процессы, как Полимеризация, термический Крекингуглеводородов, хлорирование углеводородов и т.д.
Сопряжённые реакции, такие реакции химические, которые протекают только совместно и при наличии хотя бы одного общего реагента. Примером С. р. может служить совместное окисление окиси углерода и водорода: 2H2 + O2 = 2H2O и 2CO + О2 = 2CO2. Вторая реакция в отсутствие водорода не идёт до очень высоких температур, при добавлении же в систему H2 она становится легко осуществимой.
Вопрос 4) Вконденсационно-кристаллизационных структурах частицы соединены непосредственно, без разделения их водной пленкой. Так, в массах, содержащих минеральные вяжущие вещества, коагуля-ционная структура сохраняется непродолжительное время и в период твердения в ней возникают элементы кристаллизационной структуры. Связанность такой системы в значительной степени определяется кристаллизационными все возрастающими связями.более прочные конденсационно-кристаллизационные структуры разрушаются необратимо при механическом воздействии
Билет32
Вопрос 1)Rm=(n2-1\n2+2)*(M\p)=(1,3611(в квадрате)-1\1,3611(в квадрате)+2)*(0,8525\3,8525)=12,89
Вопрос 3) Полиэлектролит — полимер, в состав молекул которого входят группы, способные к ионизации в растворе. Полиэлектролиты применяются в технике в качествекоагулянтов для очистки сточных вод, в качестве диспергаторов для снижения вязкости высококонцентрированных дисперсных систем на водной основе (суспензии ипасты в производстве керамики). Эффективность полиэлектролитов в этих приложениях объясняется адсорбцией полиионов на поверхность частиц с формированиемдвойного электрического слоя, эффективно снижающего трение между частицами. К полиэлектролитам относятся важнейшие биологические полимеры (биополимеры) — белки, нуклеиновые кислоты. Они играют важную роль в регулировании вязкости крови. Большое практическое значение имеют иониты.Изоэлектрическая точка
значение рН среды (точнее, несколько значений, зона), при к-ром молекулы вещества (напр., белки) иликлетки, находящиеся в этой среде, имеют нулевой потенциал и не передвигаются в электрофоретическомполе.
И. т. измеряют электрофоретическойподвижностью взвесей в буферных р-рах с последовательными изменениями рН, методом изоэлектрическойфокусировки, интенсивностью окраски объекта основными и кислотными красителями в среде с различнымизначениями рН.
Вопрос 4) Одним из важнейших свойств растворов коллоидных ПАВ, из-за которого они находят широкое применение в различных отраслях народного хозяйства и в меди–цине, является солюбилизация. Механизм солюбили-зации заключается в растворении неполярных ве–ществ в гидрофобном ядре мицелл.
Явление солюбилизации широко используется в раз–личных отраслях народного хозяйства: в пищевой про–мышленности, в фармацевтической (для получения жидких форм лекарственных веществ). В системе «во–да – фосфолипид» при встряхивании, перемешивании образуются сферические мицеллы – липосомы. Моле–кулы фосфолипидов образуют в липосомах бислойную мембрану, в которой полярные группы обращены к во–де, а неполярные друг к другу. Липосомы можно рас–сматривать как модель биологических мембран. С их помощью можно изучать проницаемость мембран и влияние на нее разного рода факторов для различных соединений.
Вопрос 2.Закон Бугера — Ламберта — Бера применим только для сред, в которых агрегаты молекул, отдельные молекулы или ионы, которые являются поглощающими центрами, остаются неизменными. Если характер поглощающих центров меняется, например, в связи с разбавлением, то показатель поглощения будет неодинаков для различных концентраций этого вещества. Отсюда возникают отклонения от основного закона спектрофотометрии, которые особенно заметны для концентрированных растворов. Если в исследуемом растворе присутствуют посторонние электролиты, то они могут вызвать деформацию молекул окрашенных соединений и светопоглощение этих соединений изменяется. На светопоглощение раствора влияют и многие другие факторы: гидролиз, комплексообразование, образование промежуточных продуктов, золей, таутомерные превращения, сольватация и др. Все эти явления часто зависят от раствора
Вопрос.3. Химическое равновесие. Принцип Ле Шателье. Химические реакции, которые протекают со сравнимыми скоростями в обоих направлениях, называются обратимыми. В таких реакциях образуются равновесные смеси реагентов и продуктов, состав которых далее уже не меняется со временем. Например, при нагревании происходят следующие превращения:
Вопрос 4 Коагуляция смесями электролитов. Возможны три случая совместного действиясмеси из двух или более электролитов на коллоидный раствор (рис. 66) 1) суммирование коагулирующего действия электролитов (аддитивность) 2) один электролит ослабляет действие другого (антагонизм) 3) один электролит усиливает действие другого (синергизм).. Первая количественная теория коагуляции смесями электролитов была развита Ю. М. Глазманом на основе современной физической теории коагуляциилиофобных золей. Согласно этой теории антагонизм ионов (а также противоположный эффект — синергизм) для сильно заряженных золей есть следствие электростатических взаимодействий в диффузных атмосферахколлоидных частиц, а для слабо заряженных золей может обусловливаться конкуренцией ионов за места в адсорбционном слое.
Билет
В середине XIX века немецкий химик К.Мор обобщил все созданные к тому времени титриметрические методики и показал, что в основе любой методики лежит один и тот же принцип. К раствору пробы, содержащей определяемый компонент Х, всегда прибавляют раствор с точно известной концентрацией реагента R (титрант). Этот процесс и называют титрованием. Проводя титрование, аналитик следит за протеканием химической реакции между Х и добавляемым R. По достижении точки эквивалентности (т.экв.), когда число молей эквивалентов введенного Rточно сравняется с числом молей эквивалентов находившегося в пробе вещества Х, титрование прекращают и измеряют объем затраченного титранта. Момент окончания титрования называют конечной точкой титрования (к.т.т.), ее, как и т.экв., выражают в единицах объема, обычно в миллилитрах. В идеальном случае Vк.т.т = Vт.экв., но на практике точное совпадение по разным причинам не достигается, титрование заканчивают чуть раньше или, наоборот, чуть позже, чем будет достигнута т.экв. Естественно, титрование следует проводить так, чтобы различие междуVт.экв. и Vк.т.т. было бы как можно меньшим.
Поскольку массу или концентрацию Х рассчитывают по объему титранта, затраченному на титрование пробы (по Vк.т.т.), в прошлом титриметрию называли объемным анализом. Это название нередко используют и сегодня, но термин титриметрический анализ более точен.
Вопрос 2. Способы выражения концентраций растворов
Массовая доля вещества
Массовая доля обозначается греческой буквой «омега» и равна отношению массы растворенного вещества к общей массе растворов 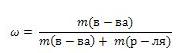
Титр
количество вещества (в граммах), растворённое в 1 мл. раствора. Различают титр по растворённому веществу (например, титр раствора соляной кислоты — THCl) или титр по определяемому веществу (например, титр раствора соляной кислоты по едкому натру — THCl/NaOH) 
Вопрос 3. Свободная энергия Гиббса (или просто энергия Гиббса, или потенциал Гиббса, или термодинамический потенциал в узком смысле) — это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на вопрос о принципиальной возможности протекания химической реакции; это термодинамический потенциал следующего вида:
Энергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкости и т. д.)
Понятие энергии Гиббса широко используется в термодинамике и химии.
Самопроизвольное протекание изобарно-изотермического процесса определяется двумя факторами: энтальпийным, связанным с уменьшением энтальпии системы (ΔH), и энтропийным T ΔS, обусловленным увеличением беспорядка в системе вследствие роста еёэнтропии. Разность этих термодинамических факторов является функцией состояния системы, называемой изобарно-изотермическим потенциалом или свободной энергией Гиббса (G, кДж)
Энергия Гиббса. Энергия Гельмгольца. Этими фундаментальными функциями являются энергия Гиббса1 и энергия Гельмгольца. 2 Они выражаются через известные нам термодинамические функции энтальпии, энтропии и температуру следующим образом:
G = Н – TS – энергия Гиббса
F = U –TS – энергия Гельмгольца
Изменение энергии Гиббса rGT ∆ в ходе изобарно-изотермических (P,T – const) процессов и изменение энергии Гельмгольца rFT ∆ в ходе изохорно-изотермических процессов (V,T – const) являются выражениями для максимальной работы Wmax в этих процессах:
Вопрос 4. Пове́рхностные явле́ния — совокупность явлений, обусловленных особыми свойствами тонких слоёв вещества на границе соприкосновения фаз. К поверхностным явлениям относятся процессы, происходящие на границе раздела фаз, в межфазном поверхностном слое и возникающие в результате взаимодействия сопряжённых фаз.
Поверхностные явления обусловлены тем, что в поверхностных слоях на межфазных границах вследствие различного состава и строения соприкасающихся фаз и соответственно из-за различия в связях поверхностных атомов и молекул со стороны разных фаз существует ненасыщенное поле межатомных, межмолекулярных сил. Вследствие этого атомы и молекулы в поверхностных слоях образуют особую структуру, а вещество принимает особое состояние, отличающееся от его состояния в объеме фаз различными свойствами. Поверхностные явления изучаются коллоидной химией.