Что называют компонентом сплава
Основы теории сплавов
1. Основные сведения о сплавах
Чистые металлы характеризуются низким пределом прочности, поэтому в машиностроении применяют главным образом их сплавы. Металлическим сплавом называют сложное вещество, полученное сплавлением (или спеканием) нескольких металлов или металлов с неметаллами. При этом улучшаются эксплуатационные и технологические свойства металлического материала.
Компонентами называют вещества, образующие систему. Чистый металл представляет собой однокомпонентную систему, сплав двух металлов — двухкомпонентную систему и т.д. Фазой называют однородную часть системы, имеющую одинаковый состав, одно и то же агрегатное состояние и отделенную от остальных частей системы поверхность раздела, при переходе через которую химический состав или структура вещества изменяются скачкообразно. Совокупность фаз, находящихся в равновесии при определенных внешних условиях (давлении, температуре), называют системой.
Сплав называют однородным (гомогенным), если его структура однофазна, и разнородным (гетерогенным), если его структура состоит из нескольких фаз.
Под структурой сплава понимают видимое в микроскоп взаимное расположение фаз, их форму и размеры. Твердые растворы образуются в результате перехода в твердое состояние однородных жидких растворов. Твердые растворы бывают следующих типов: твердые растворы замещения и твердые растворы внедрения. Независимо от типа твердые растворы однофазны.
Химические соединения образуются при сплавлении различных металлов или металла с неметаллом. Химическое соединение — однородное кристаллическое тело, имеющее кристаллическую решетку с упорядоченным расположением атомов, которая отлична от решеток элементов, образующих это соединение.
Механическая смесь двух компонентов А и В образуется тогда, когда при кристаллизации компоненты сплава неспособны к взаимному растворению в твердом состоянии и не вступают в химическую реакцию с образованием соединения. Рентгенограмма сплава отчетливо показывает наличие двух решеток компонентов А и В.
Температуры, при которых изменяется строение металлов и сплавов, называют критическими точками. При плавлении и затвердевании чистые металлы имеют одну критическую точку, а сплавы — две. В интервале между этими двумя точками в сплавах существуют две фазы — жидкий сплав и кристаллы.
2. Диаграмма состояний для случая неограниченной растворимости компонентов в твердом состоянии
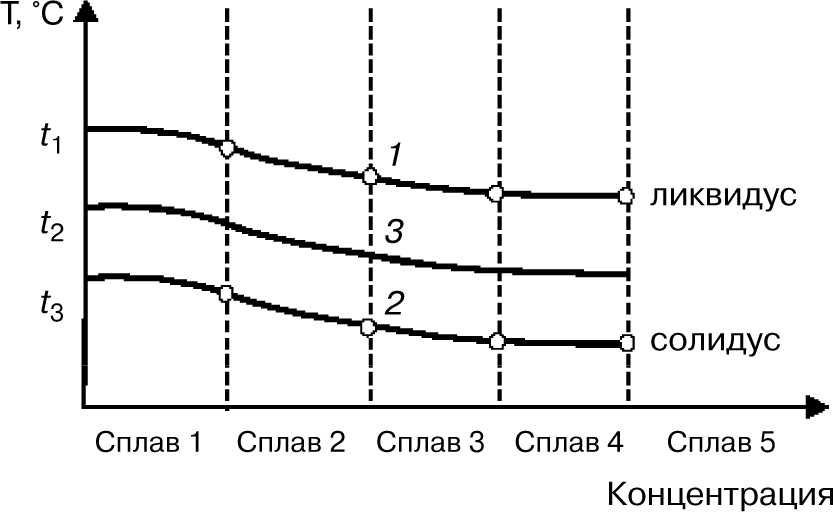
Диаграмма состояния — графическое изображение фазового состояния сплавов в зависимости от температуры и концентрации компонентов. Рассмотрим диаграмму состояния сплавов системы «медь — никель», которая является диаграммой для случая неограниченной растворимости компонентов в твердом состоянии (рис. 3).
Температура плавления меди 1083°С, никеля — 1445°С. Чистые металлы имеют одну критическую точку — температуру затвердевания (кристаллизации), а сплавы — две, т.е. сплавы, в отличие от чистых металлов, кристаллизуются в интервале температур. Например, кристаллизация сплава начинается при температуре t1, при этой температуре из жидкого сплава начинают выпадать первые кристаллы твердого раствора, а заканчивается кристаллизация при температуре t3. При этой температуре затвердевает последняя капля жидкого сплава. Разная температура конца кристаллизации сплавов свидетельствует о том, что состав твердой фазы непрерывно изменяется.
Для построения диаграммы состояния рассматриваемой системы на оси абсцисс сетки в координатах температура — концентрация откладывают составы пяти сплавов и восстанавливают из каждой точки вертикальные линии. После этого переносят на эти вертикальные линии с кривых охлаждения сплавов критические точки, а на левой и правой ординатах температур отмечают температуры кристаллизации чистых металлов — меди (100%) и никеля (100%). Соединив плавными кривыми температуры начала и конца кристаллизации всех сплавов, получают диаграмму состояния сплавов системы «медь — никель» с неограниченной растворимостью компонентов в твердом состоянии.
Верхняя линия на диаграмме обозначает начало затвердевания при охлаждении или конец расплавления при нагреве, нижняя — соответственно конец затвердевания или начало плавления. Эта диаграмма состояния сплава меди и никеля имеет три области. Область существования жидкого расплава
(1) лежит выше верхней линии, соединяющей точки плавления меди и никеля, а область существования кристаллических твердых растворов (2) — ниже нижней линии. Между этими линиями находится двухфазная область (3), в которой одновременно существуют расплав и кристаллы твердого раствора. Верхнюю границу этой области называют линией ликвидус, а нижнюю — линией солидус («ликвидус» в переводе с латинского означает жидкий, «солидус» — твердый). По диаграмме состояния можно определить концентрации твердой и жидкой фаз в сплаве при его кристаллизации.
3. Диаграмма состояний сплавов, образующих механические смеси из чистых компонентов
Диаграммы состояния — показатели фазового состояния сплавов в зависимости от температуры и концентрации компонентов. Диаграммы состояния строят для условий равновесия, т.е. такого состояния сплава, которое достигается при очень малых скоростях охлаждения или длительном нагреве. Диаграммы состояния сплавов в равновесном состоянии являются теоретическими диаграммами, так как истинное равновесие в практических условиях достигается редко.
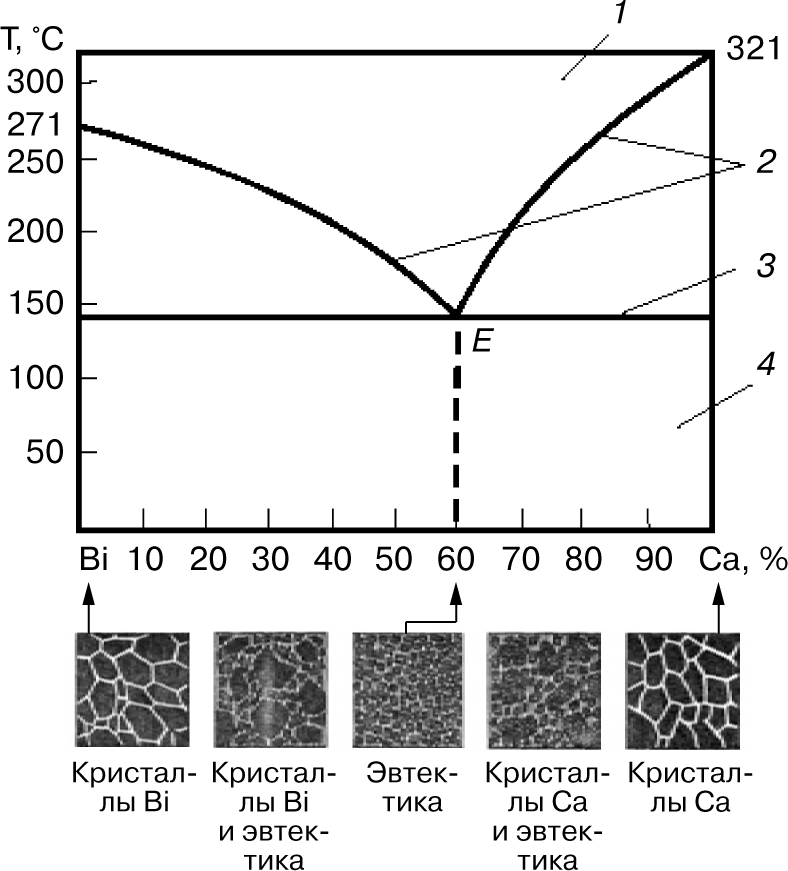
Рассмотрим диаграмму состояний одного из сплавов, образующих механические смеси из чистых компонентов, системы «висмут — кадмий» (рис. 4).
Область существования жидкого расплава ограничена сверху ломаной линией, соединяющей точки плавления висмута и кадмия через точку Е. В точке Е сплав (40% висмута и 60% кадмия) имеет одинаковые температуры ликвидуса и солидуса. Все остальные сплавы системы затвердевают и плавятся в пределах температурного интервала, который снизу ограничен горизонтальной линией солидуса. Сплав в точке Е имеет очень мелкие кристаллы висмута и кадмия, находящиеся в определенном взаимном расположении. Этот сплав называется эвтектикой, что в переводе с греческого означает легко плавящийся. Эвтектика — это механическая смесь двух (или более) видов кристаллов, одновременно кристаллизующихся из жидкого сплава. Твердые сплавы, лежащие левее эвтектической точки Е, и сплавы, содержащие до 40% висмута, называют доэвтектическими, а лежащие правее точки Е и содержащие более 40% висмута — заэвтектическими. Доэвтектические сплавы состоят из смеси кристаллов висмута и эвтектики (кристаллы висмута + кристаллы кадмия), а заэвтектические — из смеси кристаллов кадмия с эвтектикой.
По этому типу диаграммы состояния кристаллизуются также сплавы систем Zn—Sn, Pb—Ag, Ni—Cr, Cr—Mn, Cu—Bi, Al—Si.
4. Диаграмма состояния сплавов для случая ограниченной растворимости компонентов в твердом состоянии
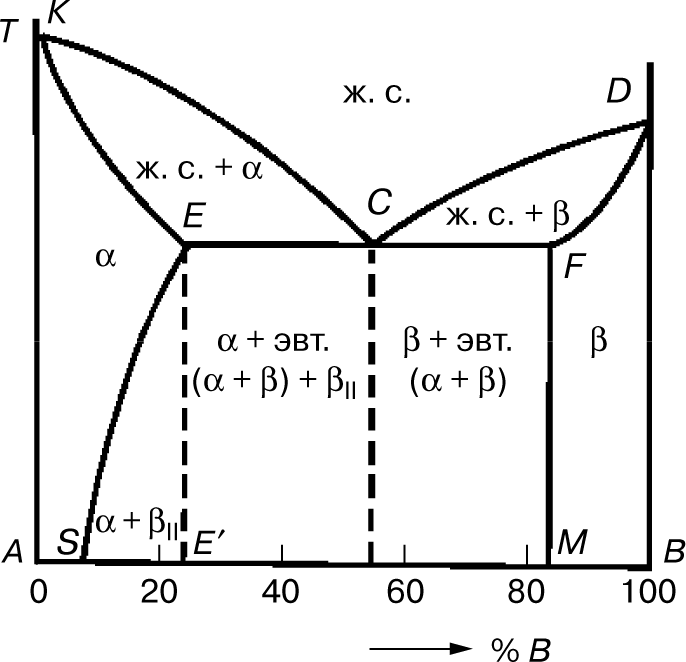
Эта диаграмма состояний содержит три фазы — жидкий раствор, твердый раствор компонента В в компоненте А () и твердый раствор компонента А в компоненте В (α). Линия диаграммы KCD — линия ликвидуса, линия KECFD — линия солидуса (рис. 5). Кристаллы α выделяются из жидкого сплава (ж. с.) по линии ликвидуса КС, а кристаллы β — по линии CD. Затвердевание сплавов происходит по линии солидуса КЕ с образованием кристаллов α и по линии DF — с образованием кристаллов β. Одновременная кристаллизация α- и β-фаз с образованием механической смеси кристаллов этих фаз происходит на линии солидуса ECF.
Сплав состава точки С после затвердевания называется эвтектическим, поскольку он состоит только из одной эвтектики α + β. Составы сплавов, лежащих левее эвтектической точки С на линии ЕС после затвердевания, называются доэвтектическими сплавами и имеют структуру α + эвтектика (α + β). Составы сплавов, лежащих правее точки С на линии CF после затвердевания, называются заэвтектическими сплавами и имеют структуру β + эвтектика (α + β).
Предельная растворимость компонента В в А характеризуется точкой Е, а А в В — точкой F. При кристаллизации сплавов, состав которых находится левее точки S (или правее точки М), при любой температуре в твердом состоянии все количество компонента В (или А) находится в твердом растворе, и структура таких сплавов состоит из зерен α (или β).
В сплавах, состав которых находится между точками S и Е′, образовавшихся при затвердевании, кристаллы α при понижении температуры ниже линии ES пересыщены компонентом В, и поэтому из них происходит выделение избыточных кристаллов. Это кристаллы β концентрации точки М, называемые вторичными (βII). Такие сплавы после полного охлаждения имеют структуру, состоящую из кристаллов α состава точки S и кристаллов βII, т.е. α + βII.
В сплавах состава линии ЕС, имеющих после затвердевания структуру α + эвтектика (α + β), из кристаллов α выделяются кристаллы β, и после полного охлаждения структура будет α + эвтектика (α + β) + βII.
5. Диаграмма состояния сплавов, образующих химические соединения
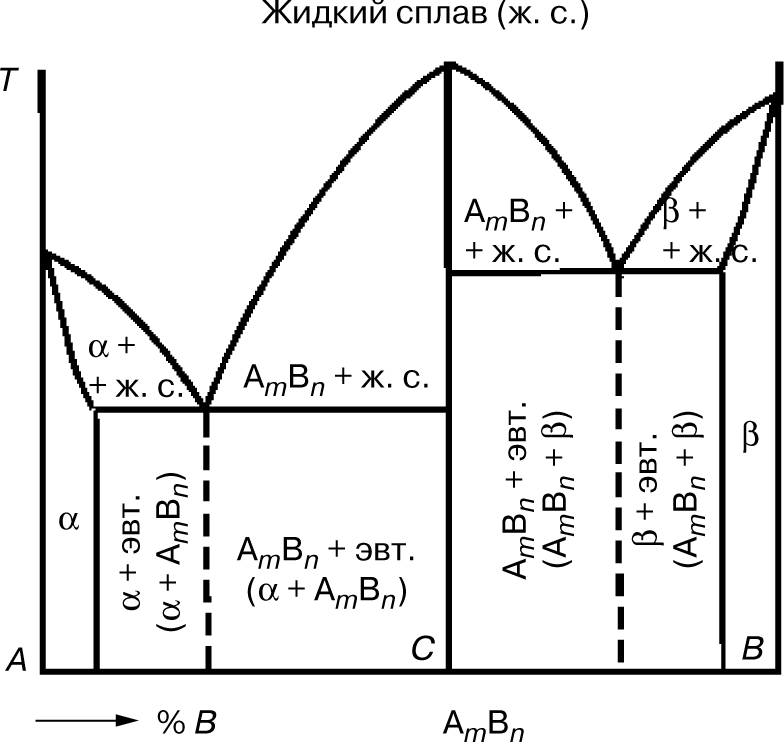
Сплавы, представляющие собой химическое соединение компонентов А и В, имеют сложную диаграмму состояния. Химическое соединение обозначают АmВn, т.е. в соединении на m атомов компонента А приходится n атомов компонента В. Химические соединения представляют собой сложное соединение с одной точкой плавления, в отличие от сплавов, у которых таких точек две.
В данной системе различают три фазы:
Эта диаграмма как бы составлена из диаграмм для двух систем:
В сплавах левее точки С компонента А больше, чем входит
в химическое соединение АmВn. В этих сплавах левее точки промежуточного состояния образуется эвтектика α + АmВn. В сплавах правее точки С компонента В больше, чем может
входить в химическое соединение АmВn. В этих сплавах образуется эвтектика АmВn+ β.
Между составом и структурой сплава, определяемой типом, диаграммой состояния и свойствами сплава, существует определенная зависимость (правило Н.С. Курнакова). В механических смесях свойства (твердость Н, электропроводность Е, вязкость, хрупкость и др.) изменяются линейно. В твердых растворах свойства изменяются по криволинейной зависимости. В химических соединениях свойства выражаются ломаными линиями.
При концентрации, соответствующей химическому соединению, отмечается характерный перелом на кривой свойств, так как химические соединения обладают индивидуальными свойствами, отличающимися от свойств компонентов. По диаграммам можно определять и технологические свойства сплавов, что облегчает выбор материала для изготовления изделий.
6. Структурные составляющие железоуглеродистых сплавов
Основными компонентами, от которых зависят структура и свойства железоуглеродистых сплавов, являются железо и углерод. Чистое железо — металл серебристо-белого цвета; температура плавления 1539°С. Железо имеет две полиморфные модификации: α и γ. Модификация α существует при температурах ниже 91°С и выше 1392°С; γ-железо — при температуре 911…1392°С. В зависимости от температуры и концентрации углерода железоуглеродистые сплавы имеют следующие структурные составляющие:
Помимо перечисленных структурных составляющих, в железоуглеродистых сплавах могут быть нежелательные неметаллические включения: окислы, нитриды, сульфиды, фосфиды — соединения с кислородом, азотом, серой и фосфором.
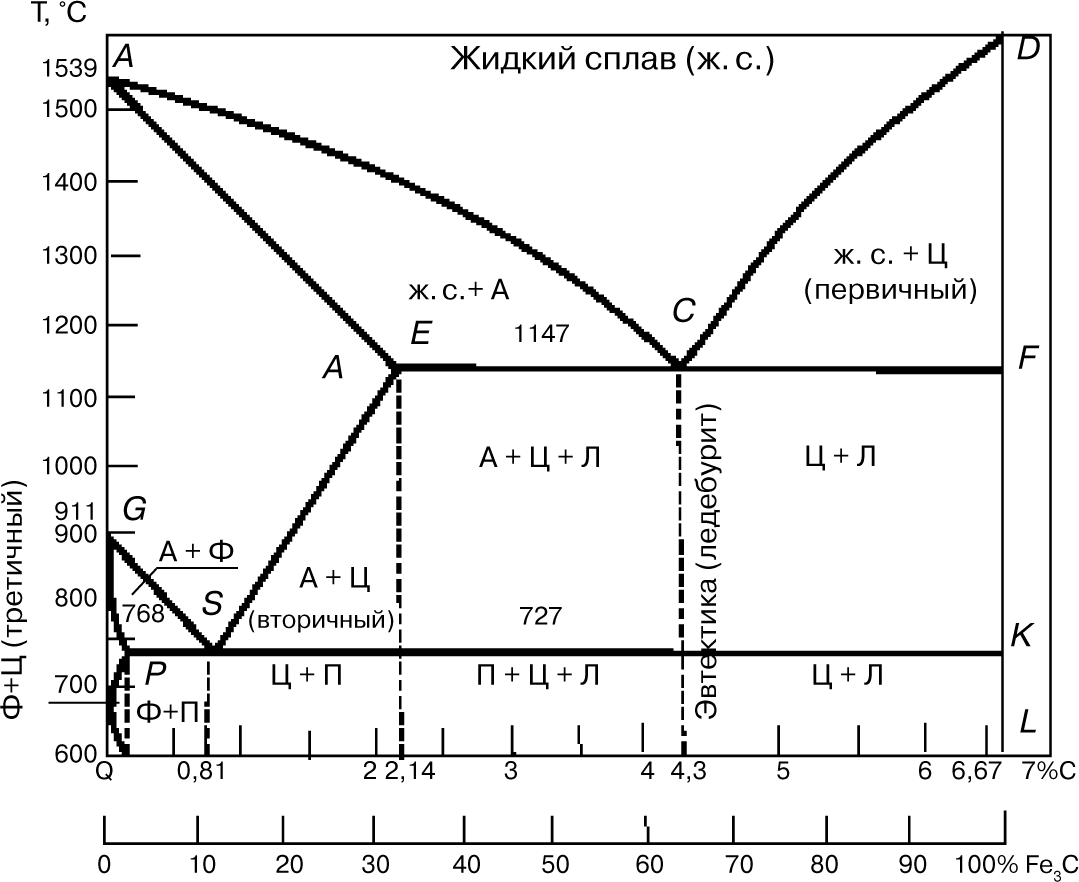
7. Диаграмма состояния «железо — цементит»
Диаграмма (рис. 7) показывает фазовый состав и структуру сплавов с концентрацией от чистого железа до цементита (6,67%). Сплавы с содержанием углерода 2,14% называют сталью, а от 2,14 до 6,67% — чугуном.
Первичная кристаллизация, т.е. затвердевание жидкого сплава, начинается при температурах, соответствующих линии ликвидуса. Точка А на этой диаграмме соответствует температуре плавления 1539°С (затвердевания) железа, точка D — температура плавления (затвердения)
Линия солидуса AEСF соответствует температурам конца затвердевания. При температурах, соответствующих линии АС, из жидкого сплава кристаллизуется аустенит, а линии CD — цементит, называемый первичным цементитом.
В точке С при 1147°С и содержании углерода 4,3% из жидкого сплава одновременно кристаллизуются аустенит (А) и цементит (Ц) (первичный), образуя эвтектику — ледебурит (Л).
При температурах, соответствующих линии солидуса АЕ, сплавы с содержанием углерода до 2,14% окончательно затвердевают с образованием аустенита. На линии солидуса ECF сплавы с содержанием углерода от 2,14 до 6,67% окончательно затвердевают с образованием эвтектики (ледебурита) и структур, образовавшихся ранее из жидкого сплава, а именно: в интервале 2,14…4,3%, С — аустенита, а в интервале 4,3…6,67% С — цементита первичного.
В результате первичной кристаллизации во всех сплавах с содержанием углерода до 2,14% (т.е. в сталях) образуется однофазная структура — аустенит. В сплавах с содержанием углерода более 2,14% (т.е. в чугунах) при первичной кристаллизации образуется эвтектика ледебурита.
Вторичная кристаллизация (превращение в твердом состоянии) происходит при температурах, соответствующих линиям GSE, PSK и GPQ. Превращения в твердом состоянии происходят вследствие перехода железа из одной аллотропической модификации в другую ( в ) и в связи с изменением растворимости углерода в аустените и феррите. С понижением температуры растворимость уменьшается. Избыток углерода выделяется из твердых растворов в виде цементита. В области диаграммы AGSE находится аустенит.
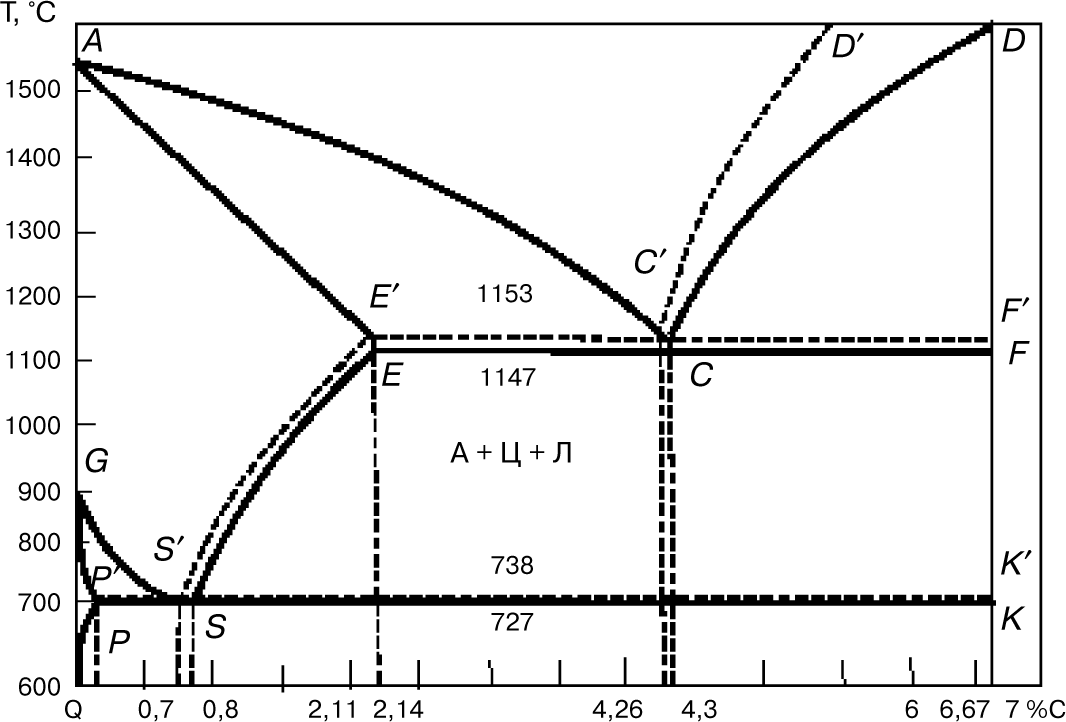
8. Диаграмма состояния «железо — графит»
Систему «железо — цементит» называют метастабильной, т.е. неустойчивой, так как при определенных условиях цементит распадается на аустенит и свободный углерод в виде графита. При очень медленном охлаждении из расплава в процессе кристаллизации углерод выделяется в виде графита. Систему «железо — графит» называют стабильной.
Процесс кристаллизации графита в сплавах железа с углеродом называют графитизацией. Она может происходить и в твердом состоянии, поскольку цементит при высоких температурах неустойчив. В этом случае графитизация происходит в несколько накладывающихся стадий:
На рис. 8 показана совмещенная диаграмма: сплошными линиями изображена метастабильная диаграмма «железо — цементит», штриховыми линиями — стабильная диаграмма. По диаграмме «железо — цементит» в области чугунов получают белые чугуны, а по диаграмме «железо — графит» — серые чугуны.
На диаграмме «железо — графит» горизонтальные линии E′C′F ′ и P ′S′K′ лежат несколько выше, а наклонные линии C′D′ и E′S′ — несколько левее соответствующих линий диаграммы «железо — цементит». На диаграмме «железо — графит» линия AC′D′ — линия ликвидуса. При охлаждении расплава по ветви АС выделяется аустенит, а по ветви C′D′ — графит (первичный).
На линии солидуса E′C′F′ при температуре 1153°С образуется эвтектика, состоящая из графита и аустенита. Ее называют графитной эвтектикой. При понижении температуры в системе «железо — графит» из аустенита будет выделяться графит, который называют вторичным. На линии P′S′K′ при температуре 738°С аустенит, содержащий 0,7% углерода (точка S′), распадается, образуя эвтектоид, состоящий из феррита и графита. Этот эвтектоид называют графитным. После полного охлаждения структура состоит из феррита и графита (эвтектического, вторичного и эвтектоидного).
Учебные материалы
Чистые металлы находят довольно ограниченное применение в качестве конструкционных материалов. Основными конструкционными материалами являются сплавы. Они обладают более ценными комплексами механических, физических и технологических свойств, чем чистые металлы.
Сплавом называют вещество, полученное сплавлением двух или более элементов (компонентов).
Сплав, приготовленный преимущественно из металлических элементов и обладающий металлическими свойствами, называют металлическим сплавом. Металлические сплавы можно также получать методами порошковой металлургии (спеканием), диффузией, осаждением нескольких элементов на катоде при электролизе водных растворов.
К основным понятиям в теории сплавов относятся система, компонент, фаза.
Система — группа тел, выделяемых для наблюдений и изучения. В металловедении системами являются металлы и металлические сплавы.
Компонентами называют вещества, образующие систему, взятые в наименьшем количестве. В металлических сплавах компонентами могут быть элементы (металлы и неметаллы) и химические соединения (не диссоциирующие при нагревании). Чистые компоненты обозначаются прописными буквами латинского алфавита А, В, С, Д.
Фазой называется однородная часть системы, отделенная от другой части системы поверхностью раздела, при переходе через которую состав, строение и свойства изменяются скачком.
Сплавы могут быть однофазными, двухфазными, трехфазными.
В зависимости от физико-химического взаимодействия компонентов могут образовываться следующие фазы: жидкие растворы, твердые растворы и химические соединения.
Почти все металлы в жидком состоянии растворяются друг в друге в любых соотношениях. В результате образуется однородный жидкий раствор с равномерным распределением атомов одного металла среди атомов другого металла.
Твердые растворы — это фазы, в которых один из компонентов сплава сохраняет свою кристаллическую решетку, а атомы других (или другого) компонентов располагаются в решетке первого компонента (растворителя), изменяя ее размеры.
Таким образом, твердый раствор, состоящий из двух или нескольких компонентов, имеет один тип решетки и представляет собой одну фазу.
В зависимости от характера распределения атомов элемента различают твердые растворы внедрения, замещения и вычитания.
В твердых растворах внедрения атомы растворимого элемента распределяются в кристаллической решетке металла-растворителя, занимая места между его атомами. Разместиться в таких пустотах могут только атомы с очень малыми размерами. Наименьшие размеры атомов имеют некоторые металлоиды и водород, азот, углерод, бор, которые и образуют с металлами твердые растворы внедрения.
В твердых растворах замещения атомы растворимого элемента занимают места атомов основного металла. Посторонние атомы могут замещать атомы растворителя в любых местах, поэтому такие растворы называют неупорядоченными твердыми растворами.
Твердые растворы замещения могут быть ограниченной и неограниченной растворимости. Так, в алюминии может растворяться до 5,5 % меди, в меди — до 39% цинка. Неограниченной растворимостью обладают, например, компоненты систем: Сu-Ni, Cu-Au, Ag-Au, Cu-Pt, Fe-Cr, Fe-Ni. Для образования твердых растворов неограниченной растворимости должны выполняться следующие условия: компоненты должны иметь одинаковые по типу кристаллические решетки; различие в атомных размерах компонентов должно быть незначительным и не превышать 8…15 % (например, Аg и Cu — DR = 0,2%, Сu и Ni — DR = 2,7 %); компоненты должны принадлежать к одной и той же группе периодичной системы или смежной родственной группе и иметь в атомах близкое строение валентной оболочки электронов.
В некоторых сплавах с понижением температуры в твердых растворах замещения может произойти процесс перераспределения атомов, в результате которого атомы растворенного элемента займут строго определенные места в решетке растворителя. Такие твердые растворы называют упорядоченными, а их структуру — сверхструктурой. Температуру перехода в упорядоченное состояние называют ”точкой Курнакова”. Полностью упорядоченные растворы образуются, когда отношение компонентов в сплаве равно целому числу: 1:1, 1:2, 1:3 и т.д. В этом случае сплаву можно приписать формулу химического соединения, например, CuAu, Cu3Au. Их можно рассматривать как промежуточные фазы между твердыми растворами и химическими соединениями. В отличие от химического соединения сохраняется решетка растворителя, и при нагреве выше точки Курнакова степень упорядочения постепенно уменьшается и они становятся неупорядоченными. Упорядоченные твердые растворы характеризуются большей твердостью, прочностью, меньшей пластичностью и электросопротивлением.
Твердые растворы вычитания образуются на основе некоторых химических соединений, когда к этому химическому соединению добавляется один из входящих в его формулу элементов. Атомы этого элемента занимают нормальные положения в решетке соединения, а места, где должны были бы находиться атомы второго компонента, оказываются незаполненными, пустыми. Такие твердые растворы образуются, например, при сплавлении химического соединения NiAl с Аl, карбида титана ТiС с Тi, когда FeО растворяет кислород.
Твердые растворы принято обозначать строчными буквами греческого алфавита a, b, g, d.
Химические соединения и родственные им по природе фазы в металлических сплавах многообразны. Они обычно образуются элементами, имеющими большое различие в электронном строении атомов и кристаллических решетках.
Характерные особенности химических соединений:
Образование химического соединения сопровождается значительным тепловым эффектом.
Соединения одних металлов с другими называются интерметаллидами. Связь между атомами в интерметаллидах чаще металлическая. Примером являются соединения Мg2Sn, Мg2Pb.
При образовании химического соединения металла с неметаллом возникает ионная связь, например, в соединении NaCl.
Переходные металлы (Fe, Mn, Cr, Mo, W, V и др.) образуют с углеродом карбиды, с азотом нитриды, с бором бориды, с водородом гидриды (железо гидридов не образует) Они имеют общность строения и свойств и называются фазами внедрения. Они имеют формулы: МХ (WC, VC, TiC, NbC, TiN, VN, и др.); М2Х (W2C, Mo2C, Fe2N и др.); М4 Х (Fe4N, Mn4N и др.).
Кристаллическая структура фаз внедрения определяется соотношением атомных радиусов неметалла (Rx) и металла (Rм). Если Rx/Rм
Дальше >
Характеристика основных фаз в сплавах








Характеристика основных фаз в сплавах
В зависимости от физико-химического взаимодействия компонентов в сплаве образуется фаза, количество и вид которой характеризуют состояние сплава. Фаза представляет собой однородную часть сплава, характеризующуюся определенным составом, свойствами, типом кристаллической решетки, и отделена от остальной части сплава границей раздела. Под структурой понимают форму, размер и свойства взаимного расположения фаз в сплаве. Фазовый состав и структура, определяющие свойства сплава, зависят от состава и технологии его обработки.
В сплавах возможно образование следующих фаз: 1)жидкий раствор;2)твердый чистый металл;3)твердый раствор;4) соединение. Людмила Фирмаль
В зависимости от количества фаз, сплав может быть однофазным, двухфазным, многофазным. В жидком состоянии компоненты сплава обычно растворяются бесконечно друг с другом, образуя жидкий раствор. В твердом состоянии компоненты могут образовываться: 1) смесь двух фаз или более-это механические смеси;2) соединение, когда компоненты вступают в химическое взаимодействие;3) твердый раствор-это смесь двух фаз или более. Когда элементы, содержащиеся в сплаве, затвердевают из жидкого состояния, если они не растворяются и не взаимодействуют друг с другом, образуется механическое перемешивание. Механические смеси>образуются при кристаллизации многих сплавов, например Pb-Sb, 144ал-Си. Структура смеси неоднородна.
При металлургическом анализе на поверхности резания видны кристаллы различных компонентов, образующих механическую смесь. Химический анализ также определяет различные элементы. Методом рентгеновской дифракции были определены два типа кристаллических решеток, образующих такие смеси. Если элементы, составляющие составной сплав, взаимодействуют друг с другом, то образуется соединение. По структуре они представляют собой однородное твердое тело. Свойства соединений отличаются от свойств их компонентов. Они имеют постоянную температуру плавления (диссоциации). Рентгеноструктурный анализ выявил разницу между кристаллической решеткой соединения и исходным элементом.
Соединения этой группы имеют строго стехиометрический состав, их формула определяется валентностью составляющих элементов. В структуре сплава, они находятся в виде неметаллических включений, таких как сульфиды, оксиды, фосфиды. Например, оксид марганца MPO, карбид железа Fe3C и так далее. Фаза введения состоит из железа, марганца, хрома, вольфрама, молибдена и других металлов, а также фаз с неметаллами малого атомного диаметра, таких как углерод, азот, бор и водород. Условиями для образования введенной фазы являются: отношение атомного диаметра в неметаллах и металлах меньше 0,59.
Атомы металла размещаются на узлах решетки, а атомы не размещаются на узлах решетки- 145 металлов в октаэдрических или тетраэдрических отверстие. Людмила Фирмаль
Из-за малого объема пор тетраэдра в нем могут быть размещены только атомы водорода. Этот этап имеет простые химические формулы меня, Х (Fe4N, Mn4N), Me2x (Fe2N, Mo2c), Мекс (твердосплавные ВК, крестики, туалет, NBC и нитрида Фэн ВН олово), где me представляет собой металл, а X-неметаллические. Такие стадии введения, как карбиды и нитриды, обладают высокой твердостью. На основе стадии введения с избытком атомов металла может быть образован твердый раствор. Системы металл-металл включают электронные составные соединения (фаза перегара-четки), фазу лавеса и о-фазу. С одной стороны, электронное соединение образуется между металлом одновалентного (si, Ag, Li) металла или переходной группы (Fe, MP, Co) и металлом (A1, Be, Mg, Zn), имеющим валентность от 2 до 5. Электронное соединение представляет собой фазу переменного состава.
Этот тип соединения имеет определенную концентрацию электронов, то есть отношение числа валентных электронов к числу атомов: 3/2, 21/13, 7/4. Фазу с таким значением электронной концентрации обычно обозначают как P-фазу, u-фазу и E-фазу соответственно. К [3-электронной концентрации a=3/2 соединения обычно относятся соединения с BCC решеткой, CuZn, CuBe, Cu3Al и др. Например, в случае соединения CUZN.= (1 ■ 1 + + 2 • 1)/(1 + 1) = 3/2. Cu5zn8, Co5Zn21, Fe5Zn21 относятся к соединению U с электронной концентрацией 21/13 и сложной кубической решеткой. Соединение Cu5zng n 2= (1 ■ 5 + 2 • 8)/(5 + 8) = 21/13. Концентрация электронов 7/4 с гексагональной решеткой характерна для электронных соединений CuZn3, Cu3Sn, Cu3Si
. Для подключения cuzn3 к шестигранной решетке e N 3= (1 ■ 1 + 2 • 3) /(1 + 3) = 7/4. Электронные соединения характерны для сплавов на основе меди (латуни и бронзы), где они усиливают фазу. Стадия лавеса имеет формулу AB2. Они образуются между компонентами а и в от 1,1 до 1,6, обычно 1,2 при соотношении их атомных диаметров. Фаза Лавеса находится в ряде жаропрочных сплавов и содержит соединения tife2, TiCr2, MoFe2, NbFe2, TiCo2, которые способствуют упрочнению. Они имеют шестиугольную плотную или гранецентрированную кубическую решетку. Сигма-фаза, образованная на основе металлов с близким атомным диаметром (например, о-фаза системы Fe-SG), характеризуется очень медленным охлаждением при 600-800 ° с или высоким содержанием хрома в сплаве при изотермической выдержке.
Твердый раствор-это фаза, в которой один из компонентов (растворитель) удерживает свою кристаллическую решетку, а атомы другого(растворимого) компонента располагаются в ее решетке, искажая ее. Химический анализ твердых растворов показывает, что одним типом решетки с однородным кристаллическим зерном является несколько элементов, таких как металлический растворитель, а также металлографическая и рентгеновская дифракция. Существуют твердые растворы замещения и внедрения. Твердый замещающий раствор образуется путем замены части атомов растворителя в его кристаллической решетке атомами растворенного компонента(рис. 4.1, а).
Атомы растворенных элементов обычно не занимают особого места в кристаллической решетке, а только атомы растворителя некоторых узлов. Такое расположение атомов называется беспорядком(рис. 4.2, а). Он образуется, когда взаимодействие разнородных элементов твердого раствора недостаточно выражено. Когда атомы различных элементов в твердых растворах взаимодействуют несколько сильнее, чем однородные, они имеют тенденцию располагаться в определенном порядке. Атомы растворителя и растворенных элементов расположены на разных кристаллических плоскостях. Например, в системе Au-si после медленного охлаждения расплава некоторые кристаллографические плоскости полностью состоят из атомов меди и состоят из других атомов золота. 4.2, б).
Его называют твердым раствором, таким как: Полностью упорядоченные растворы формируются при целочисленном соотношении компонентов сплава: 1:1, 1:2, 1:3 Рис 4.1. Кристаллическая решетка замещенного твердого раствора ГЦК (А) и интегрированного твердого раствора (Б)) Рис 4.2. Расположение атомов в кристаллической решетке твердого раствора: а-неровности (сплав cu-Au); б-ордорность (сплав cu-Au); в-вычитание решетки твердого раствора Незаполненный узел решетки Сплавы с такой регулярной структурой могут характеризоваться формулой соединений, например, CuAu или Cu3Au. Упорядоченный твердый раствор характеризуется высокой твердостью и хрупкостью и считается промежуточной фазой между неупорядоченным твердым раствором и соединением.
Из-за разницы в размерах атомов, когда атомы одного компонента заменяются атомами другого, кристаллическая решетка искажается. Это искажение настолько велико, что разница в размерах атома и структуре его кристаллической решетки больше. Кроме того, когда искажение решетки чрезмерно, растворимость становится невозможной. Конечная растворимость происходит еще дальше, когда введенный атом входит в решетку и не может образовать независимую фазу. Если оба компонента имеют одинаковый тип кристаллической решетки, а атомы различаются по диаметру от 8 до 15% и менее, то возможна неограниченная растворимость. Металлы с такими ГЦК решетками имеют незначительную разницу в атомных размерах АВ, таких как Ag и Au(LV=0,2%), Ni и si (AB=2,7%) и др.
Подобно металлам с ГЦК решетками, МО и W (AB=9,9%), V и Ti (AB=2%) бесконечно растворяются в твердом состоянии. Металлы с большими атомными диаметрами (Na, CA, R) Fe, si, Ni нерастворимы. Конечная растворимость также зависит от различия в структуре валентной оболочки. Одновалентных металлов полностью растворяются только в моновалентных КР-АГ, АГ-п, медно-никелевый. Ограниченная растворимость компонентов возникает при достижении критического значения электронной концентрации Концентрация электронов в растворе составляет 148 Н, что соответствует числу валентных электронов на атом. Для ОЦК решетки в N=1.36,для ГЦК решетки Н=1.40.
Если концентрация электронов превышает эти значения, то образуется новая фаза с другой кристаллической решеткой. Например, из диаграммы состояния si-Zn известно, что предел растворимости Zn в si составляет 39%. Для сплавов, содержащих 61% si и 39% Zn, N= (61 • 1 + 39 ■ 2)/100 = 1,39, это меньше, чем предельное значение 1,40. Твердый раствор образуется путем встраивания атомов растворенного компонента в междоузлия(пустоты) кристаллической решетки (рис. 4.1, б). В решетке ГЦК такие пустоты находятся в центре куба, образуя сферу диаметром 0,42), где D-диаметр атома растворителя. В ОЦК решетке пустоты расположены в центре Грани, образуя сферу диаметром 0,290. Образование твердого раствора воды, как правило, сопровождается увеличением параметров кристаллической решетки и ее искажением.
Твердый раствор не характерен для металлических сплавов с элементами 1-й и 2-й ступеней с малым атомным диаметром (C, B, N, H, O). Концентрация второго компонента в твердом растворе введения обычно ниже, чем при замещении этих элементов и твердого раствора соединения, всегда ниже. В отличие от соединений, твердые растворы не имеют кристаллической решетки растворителей металлов, а соединения образуют решетку, отличную от металлической решетки. На основе соединения-стадии введения может образовываться твердый раствор вычитания (рис. Его иногда называют твердым раствором с дефектной решеткой 4.2, б).
В таком твердом растворе число атомов растворителя уменьшается, и в решетке появляются свободные узлы. Субтрактивный раствор твердых тел образуется путем растворения атомов V, Ti, Nb, Zr в Карбидах VC, TiC, NbC, ZrC узлов, которые ранее были заняты атомами углерода. Атомы растворенного элемента накапливаются преимущественно в кристаллической решетке вблизи дислокаций, уменьшая их упругую энергию(рис. 4.3). В замещающем растворе атомы меньшего размера, чем растворитель, присутствуют в области сжатой решетки, а атомы большего размера присутствуют в зоне расширения. При образовании твердого раствора эти атомы располагаются в зоне растянутой решетки, под экстрапланой. Ближе к развертыванию они образуют группу в виде облака, называемого атмосферой Коттрелла.
Такое расположение 149 стр. 4.3. Положение атома замещения (D) и вложение (B)в область дислокации В Это сопровождается уменьшением деформации кристаллической решетки, что соответствует запасу минимальной свободной энергии. Присутствие атомов в атмосфере Котрелла вблизи дислокации тормозит их миграцию в кристаллической решетке твердого раствора и повышает его прочность. Дальнейшее напряжение необходимо для того, чтобы дислокации отошли от атмосферы Котрелла. Границы блоков и частиц являются местами скопления дислокаций и окружающей их атмосферы Котрелла, благодаря чему они оказывают большое влияние на прочность твердого раствора. Закон существования устойчивой фазы в равновесии определяется фазовым законом Гиббса.
Фазовый закон, устанавливающий количественную зависимость между числом фаз F, числом компонентов K и числом степеней свободы C, позволяет прогнозировать процессы, происходящие в сплавах при нагреве и охлаждении, и определять число фаз систем в этих условиях. Фазовый закон выражается формулой C=K+P-F. Понимается количество внешних Р (температура, давление) и внутренних (концентрация) факторов, которые могут изменяться без изменения числа фаз равновесия, под числом степеней свободы или изменчивостью системы. В случае металлических сплавов внешним коэффициентом равновесия является только температура, поскольку при работе в атмосферных условиях давление практически постоянно. Итак, для металлического сплава правило фазы принимает вид: C=K+1-F.
исперсия не может быть отрицательной. Поэтому для равновесия металлических сплавов необходимо, чтобы число фаз в их структуре не превышало 1 числа компонентов. Из этой формулы следует, что в случае кристаллизации чистого металла, если имеются две фазы (жидкая и твердая), C=K+1-f=1 + 1 — 2 =0. Эта система неизменна. Обе фазы находятся в равновесии при строго определенной температуре (температуре затвердевания). Температура меняется только тогда, когда исчезает любая из фаз. Если чистый металл находится в жидком состоянии, и существует только одна жидкая фаза, то число степеней свободы будет равно 1 (моновариантная система): C=K+1-f=1 + 1 — 1 =1. Наличие определенной степени свободы указывает на возможность изменения температуры в определенных пределах без изменения числа фаз. В двойной системе следует правило фазы, что число одновременно существующих фаз не может превышать 3. В большем количестве фаз сплав не приходит к равновесию. Правило фазы используется при построении диаграммы состояния сплава.
Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института