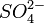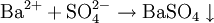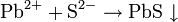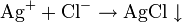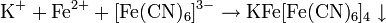Что называют качественной реакцией
Качественные реакции
Качественный анализ — совокупность химических, физико-химических и физических методов, применяемых для обнаружения элементов, радикалов и соединений, входящих в состав анализируемого вещества или смеси веществ. В качественном анализе используют легко выполнимые, характерные химические реакции, при которых наблюдается появление или исчезновение окрашивания, выделение или растворение осадка, образование газа и др. Реакции должны быть как можно более селективны и высокочувствительны. Качественный анализ в водных растворах основан на ионных реакциях и позволяет обнаружить катионы или анионы.
Качественные реакции
Примеры качественных реакций на катионы
| Катион | Воздействие и реактив | Наблюдаемая реакция |
|---|---|---|
| Li + | Пламя | Карминово-красное окрашивание |
| Na + | Пламя | Желтое окрашивание |
| K + | Пламя | Фиолетовое окрашивание |
| Ca 2 + | Пламя | Кирпично-красное окрашивание |
| Sr 2 + | Пламя | Карминово-красное окрашивание |
| Ba 2 + | 1. Пламя |
2.
2. Выпадение белого осадка, не растворимого в кислотах.
Литература
Полезное
Смотреть что такое «Качественные реакции» в других словарях:
Качественный анализ (химия) — Качественный анализ совокупность химических, физико химических и физических методов, применяемых для обнаружения элементов, радикалов и соединений, входящих в состав анализируемого вещества или смеси веществ. В качественном анализе используют… … Википедия
Молочная кислота — Молочная кислота … Википедия
Антраниловая кислота — ароматическая аминокислота. Производные антраниловой кислоты применяются в производстве … Википедия
Качественный анализ — совокупность химических, физико химических и физических методов, применяемых для обнаружения элементов, радикалов и соединений, входящих в состав анализируемого вещества или смеси веществ. В качественном анализе используют легко выполнимые,… … Википедия
Гликозиды — Гликозид кверцетина Гликозиды органические соединения, молекулы которых состоят из двух частей: углеводного (пиранозидного или фуранозидного) ос … Википедия
Е270 — Молочная кислота Молочная кислота α оксипропионовая кислота, CH3CH(OH)COOH. tпл 25–26 °С оптически активная + или – форма. tпл 18 °C рацемическая форма. Молочная кислота образуется при молочнокислом брожении сахаров, в частности в прокисшем… … Википедия
Лактат — Молочная кислота Молочная кислота α оксипропионовая кислота, CH3CH(OH)COOH. tпл 25–26 °С оптически активная + или – форма. tпл 18 °C рацемическая форма. Молочная кислота образуется при молочнокислом брожении сахаров, в частности в прокисшем… … Википедия
Полимер — (Polymer) Определение полимера, виды полимеризации, синтетические полимеры Информация об определении полимера, виды полимеризации, синтетические полимеры Содержание Содержание Определение Историческая справка Наука о Полимеризация Виды… … Энциклопедия инвестора
ЖЕЛУДОК — ЖЕЛУДОК. (gaster, ventriculus), расширенный отдел кишечника, имеющий благодаря наличию специальных желез значение особо важного пищеварительного органа. Ясно диференцированные «желудки» многих беспозвоночных, особенно членистоногих и… … Большая медицинская энциклопедия
Железо — (техн.) Ж. есть наиболее распространенный и наиболее употребительный из металлов. Ж. было известно еще египтянам во время постройки пирамид; у греков упоминается о нем в Илиаде Гомера, причем о нем говорится, как о трудно обрабатываемом металле,… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Требования к качественным реакциям.



Основные положения качественного анализа.
Сущность и методы качественного анализа.
Основной задачей качественного анализа является установление химического состава, т.е. обнаружение ионов (катионов и анионов), содержащихся в анализируемом веществе.
Химические методы обнаружения и идентификации веществ основаны на проведении аналитических реакций.
1. Образованием или растворением осадка.
Ba 2+ + SO4 2- → BaSO4↓ (белый кристаллический)
Ba 2+ + CO3 2- → BaCO3↓ (белый кристаллический)
BaSO4 не растворяется в кислотах, BaCO3 растворяется в кислотах.
2. Образованием характерных кристаллов.
Кристаллы CaSO4⋅2H2O в виде пучков или звездочек. Кристаллы
натрийуранилацетата CH3COONa⋅UO2(CH3COO)2 правильной тетраэдрической
или октаэдрической формы.
3. Появлении или изменении окраски растворов.
Водные растворы солей железа (III) окрашены в желтый цвет. При взаимодействии ионов Fe 3+ c тиоцианат-ионами раствор приобретает темно-красную окраску:
Реакции выделения газов используются для обнаружения анионов летучих и неустойчивых кислот, а также катионов аммония:
В зависимости от избирательности аналитические реакции бывают специфическими, избирательными и групповыми.
1) Специфические реакции позволяют обнаружить только один ион. Например, характерной реакцией на катион Fe +2 является реакция с красной кровяной солью, так как только с Fe +2 образует осадок синего цвета.
Специфическая реакция присуща только данному иону и позволяет обнаружить его практически при любых условиях. Такие реакции имеют еще название качественные.
3) Групповые реакции используются в анализе для выделения группы веществ. Такие реакции еще называют общими (селективными).
Требования и условия проведения качественных реакций.
Требования к качественным реакциям.
1. Реакции должны протекать быстро.
2. Реакции должны быть практически необратимы.
3. Реакции должны сопровождаться внешним эффектом.
4. Реакция должна отличаться высокой чувствительностью и по возможности специфичностью.
Чувствительность аналитических реакций определяет возможность обнаружения вещества (ионов, молекул) в растворе. Она характеризуется предельным разбавлением, предельной концентрацией, минимальным объемом предельно разбавленного раствораи открываемым минимумом
Предельное разбавление (Vlim, мл/г) – максимальный объем раствора, в котором может быть обнаружен 1 г данного вещества при помощи данной аналитической реакции.
Предельная концентрация (Clim (Cmin), г/мл) – наименьшая концентрация, при которой определяемое вещество может быть обнаружено в растворе данной аналитической реакцией.
Предельная концентрация является обратной величиной предельного разбавления:
Минимальный объем предельно разбавленного раствора (Vmin, мл) – наименьший объем анализируемого раствора, необходимый для обнаружения открываемого вещества данной аналитической реакцией.
Открываемый минимум (m, мкг) – наименьшая масса определяемого вещества, которую при определенных условиях можно открыть действием данного реагента в минимальном объеме предельно разбавленного раствора.
Взаимосвязь между показателями чувствительности реакции выражается формулой:
Аналитическая реакция тем чувствительнее, чем меньше ее открываемый минимум, минимальный объем предельно разбавленного раствора и чем больше предельное разбавление.
Чувствительность аналитических реакций не является постоянной величиной и во многих случаях зависит от условий их выполнения, а также свойств образовавшихся продуктов реакции:
1. Соответствующая среда раствора.
Например, осадки, растворимые в кислотах, не могут выпадать из растворов в присутствии кислот, а осадки, растворимые в щелочах, не выпадают из растворов в щелочной среде. Если осадок растворим в кислотах и щелочах, его можно получить только в нейтральной среде. Таким образом, среда раствора оказывает существенное влияние на ход реакции.
2. Достаточная концентрация обнаруживаемого иона.
От концентрации определяемого иона непосредственно зависит чувствительность реакции, и с возрастанием ее чувствительность реакции обычно повышается.
3. Температура раствора.
Осадки, растворимые при нагревании, могут образоваться только при комнатной температуре. Некоторые аналитические реакции протекают лишь при нагревании. Осадки, растворимость которых возрастает с повышением температуры, выпадают из нагретого раствора не полностью или совсем не выпадают. Такая реакция должна выполняться на холоду.
4.Присутствие в растворе посторонних ионов.
Даже если они и не взаимодействуют с прибавляемым реагентом, обычно снижает чувствительность аналитической реакции. Для устранения мешающего влияния посторонних ионов используют маскирование. В качестве маскирующих неорганических веществ наиболее часто применяют фториды и фосфаты щелочных металлов и аммония. Из органических соединений маскирующим действием обладают винная, лимонная, щавелевая и некоторые другие кислоты. Эти вещества образуют с мешающими ионами прочные комплексные соединения, в результате чего их мешающее действие устраняется.
Наряду с чувствительностью реакций, большое значение для анализа имеет их специфичность.
Специфическими называют реакции, аналитический эффект которых характерен только для одного иона в присутствии других ионов. Примером специфической реакции является образование темно-синего осадка «берлинской лазури» при действии гексацианоферрата(II) калия
Специфические реакции представляют большой интерес для аналитической химии, так как они позволяют открывать нужный ион в присутствии других ионов.
4.1.4. Качественные реакции на неорганические вещества и ионы.
Представим себе такую ситуацию:
Вы работаете в лаборатории и решили провести какой-либо эксперимент. Для этого вы открыли шкаф с реактивами и неожиданно увидели на одной из полок следующую картину. У двух баночек с реактивами отклеились этикетки, которые благополучно остались лежать неподалеку. При этом установить точно какой банке соответствует какая этикетка уже невозможно, а внешние признаки веществ, по которым их можно было бы различить, одинаковы.
В таком случае проблема может быть решена с использованием, так называемых, качественных реакций.
Качественными реакциями называют такие реакции, которые позволяют отличить одни вещества от других, а также узнать качественный состав неизвестных веществ.
Например, известно, что катионы некоторых металлов при внесении их солей в пламя горелки окрашивают его в определенный цвет:
Данный метод может сработать только в том случае, если различаемые вещества по разному меняют цвет пламени, или же одно из них не меняет цвет вовсе.
Но, допустим, как назло, вам определяемые вещества цвет пламени не окрашивают, или окрашивают его в один и тот же цвет.
В этих случаях придется отличать вещества с применением других реагентов.
В каком случае мы можем отличить одно вещество от другого с помощью какого-либо реагента?
Возможны два варианта:
Например, нельзя отличить воду от раствора гидроксида натрия с помощью соляной кислоты, не смотря на то, что щелочи с кислотами прекрасно реагируют:
NaOH + HCl = NaCl + H2O
Связано это с отсутствием каких-либо внешних признаков реакции. Прозрачный бесцветный раствор соляной кислоты при смешении с бесцветным раствором гидроксида образует такой же прозрачный раствор:
Но зато, можно воду от водного раствора щелочи можно различить, например, с помощью раствора хлорида магния – в данной реакции выпадает белый осадок:
2) также вещества можно отличить друг от друга, если они оба реагируют с добавляемым реагентом, но делают это по-разному.
Например, различить раствор карбоната натрия от раствора нитрата серебра можно с помощью раствора соляной кислоты.
с карбонатом натрия соляная кислота реагирует с выделением бесцветного газа без запаха — углекислого газа (СО2):
а с нитратом серебра с образованием белого творожистого осадка AgCl
Ниже в таблицах представлены различные варианты обнаружения конкретных ионов:
Качественные реакции на катионы
| Катион | Реактив | Признак реакции |
| Ba 2+ | SO4 2- | Красное окрашивание |