Что называют изотопами запишите обозначения изотопов водорода хлора
Описание изотопов: определение, состав, превращения
Что такое изотоп?
Изотопами называют видоизменные элементы периодической таблицы Менделеева, которые имеют один и тот же порядковый номер, но различную атомную массу. Название характеризует нахождение подобных структур в одной клеточке периодической таблицы с нормальными элементами (изо – равное, топ – положение, место – в переводе с английского). Состав изотопов представляет собой совокупность протонов, электронов и нейтронов (количество нейтронов обычно больше, чем в обычных элементах периодической таблицы).
Обозначения изотопов
Видоизмененные элементы периодической таблицы Менделеева обозначаются следующим образом: к символу химического элемента, к которому принадлежит изотоп, подписывается верхний левый индекс с обозначением массового числа. Так, например, изотоп кислорода, обладающий массовым числом равным восемнадцати атомных единиц, будет обозначаться следующим образом: 18 O. Имеется также другое обозначение подобных атомов (например, кислород – 18).
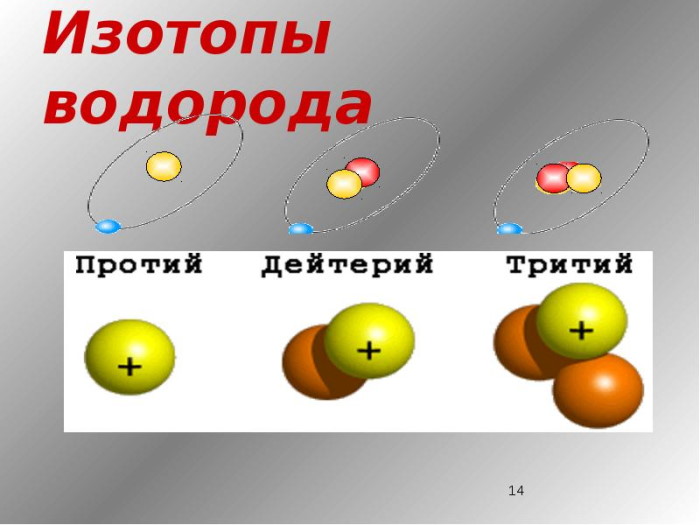
Изотопы водорода
Выделяют три видоизменённых атома водорода, обладающих разными массовыми числами:
протий (Н) – одна атомная единица массы;
дейтерий (D) – две атомные единицы массы;
тритий (Т) – три атомные единицы массы.
Отдельно необходимо выделить, видоизменённые атомы водорода, массовое число которого может колебаться в районе 4 – 7 а.е.м.
Изотопы урана
Изотопный ряд урана включает в себя изотопы, имеющие массу от 219 а.е.м. до 243 а.е.м. Элементы, обладающие наибольшей изотопной распространенностью – это уран – 235 и уран – 238.
Нуклиды
Нуклиды подразделяются на две больших категории:
Химический элемент периодической таблицы ртуть (гидраргирум) обладает наибольшей изотопной распространенностью стабильных нуклидов. Так, стабильные нуклиды ртути – это вещества изотопного ряда гидраргиума, обладающие атомной массой от 170 а.е.м. до 219 а.е.м.
Термин нуклид (в понятии радионуклид) был предложен в двадцатом веке американцем Трумэном Команом. Радионуклиды отличаются длительным периодом полураспада, который в большинстве случаев имеет значение порядка 5*10 8 лет. Таким образом, радионуклиды населяют Землю с момента ее зарождения как планеты. В зависимости от массового числа нуклиды могут подвергать различным видам превращения, обозначим некоторые из них:
альфа-распад (для большинства радионуклидов подобный вид распада не наблюдается и из-за большого периода полураспада);
нейтронный и двухнейтронный распады.
Изотопы галлия
электронный захват (наблюдается в 13% случаев);
позитронный распад (наблюдается в 87% случаев).
Превращения изотопов
Превращения изотопов могут протекать двумя способами:
при участии технологий, созданных человеком (используется в промышленности);
самопроизвольно (протекает в природе).
Выделяют следующие виды ядерных превращений, связанных со изменением атомной массы химических элементов: распад (альфа, бета, двойной бета, нейтронный, позитронный), электронный захват (происходит присоединение электрона, вследствие чего изменяется заряд и состав нуклида).
Применение радиоактивных изотопов
Изотопы химических элементов представляют собой элементы периодической таблицы Менделеева, обладающие нестабильными ядрами и свойством подвергаться различного ядерному распаду. В научной терминологии подобные атомы называют также радионуклидами. Радиоактивные изотопы применяются в различных сферах человеческой деятельности.
В сельском хозяйстве использования радиоизотопов необходимо для изучения особенностей роста, развития и функционирования корневых систем растений (такой способ изучения получил название – метод меченных атомов).
В авиастроительстве радионуклиды применяют для испытания авиационных конструкций на предмет износостойкости.
В сфере градостроительстве радиоактивные изотопы нашли свое применение как универсальные измерители плотности почвы.
В области коммунального хозяйства видоизмененные химические элементы, обладающие радиоактивной способностью, применяют в целях стерилизации постельного белья.
В текстильной промышленности радионуклиды используются для удаления электрических зарядов с поверхности одежды.
В машиностроительной отрасли радионуклиды используются для определения толщины металлического покрытия.
Особое место в этом списке занимает использование радиоактивных изотопов в химической промышленности и в сфере медицинских услуг. Так, получение различных полимерных соединений, которые составляют основу большинства современных предметов обихода, письменных принадлежностей, резиновых изделий того или иногда вида использования происходит при помощи взаимодействия y-излучения с различными химическими соединениями органической природы. В медицине радиоизотопы применяются в лечебных целях в рамках радиационной терапии (процедура, при которой под воздействием радионуклидов происходит разрушение любого типа живой ткани). Радиотерапия нашла свое применения в области лечения онкологических заболеваний (на данный момент, по эффективности радиотерапия уступает только химиотерапии, но зачастую данные способы лечения составляют две стадии одного процесса).
В заключении, стоит отметить, что научный прогресс в области получения новых видов изотопов тех или иных химических элементов не стоит на месте, поэтому возможно в будущем при помощи грамотного и целесообразного использования видоизмененных атомов можно будет лечить неизлечимые на данный момент заболеваний и строить космические корабли для покорения других планет и галактик.
изотопы
Полезное
Смотреть что такое «изотопы» в других словарях:
ИЗОТОПЫ — (от изо. и греческого topos место), разновидности химических элементов, у которых ядра атомов (нуклидов) отличаются числом нейтронов, но содержат одинаковое число протонов и поэтому занимают одно и то же место в периодической системе химических … Современная энциклопедия
Изотопы — (от изо. и греческого topos место), разновидности химических элементов, у которых ядра атомов (нуклидов) отличаются числом нейтронов, но содержат одинаковое число протонов и поэтому занимают одно и то же место в периодической системе химических … Иллюстрированный энциклопедический словарь
ИЗОТОПЫ — (от изо. и греч. topos место) разновидности химических элементов, у которых ядра атомов отличаются числом нейтронов, но содержат одинаковое число протонов и поэтому занимают одно и то же место в периодической системе элементов. Различают… … Большой Энциклопедический словарь
ИЗОТОПЫ — ИЗОТОПЫ, хим. элементы, расположенные в одной и той же клетке периодической системы и следовательно обладающие одинаковым атомным номером или порядко вым числом. При этом И. не должны, вообще говоря, обладать одинаковым атомным весом. Различные… … Большая медицинская энциклопедия
ИЗОТОПЫ — разновидности данного хим. элемента, различающиеся по массе ядер. Обладая одинаковыми зарядами ядер Z, но различаясь числом нейтронов, И. имеют одинаковое строение электронных оболочек, т. е. очень близкие хим. св ва, и занимают одно и то же… … Физическая энциклопедия
изотопы — атомы одного и того же хим. элемента, ядра которых содержат одинаковое число протонов, но различное число нейтронов; имеют разные атомные массы, обладают одними и теми же хим. свойствами, но различаются по своим физ. свойствам, в частности… … Словарь микробиологии
ИЗОТОПЫ — атомы хим. элемента, обладающие разными массовыми числами, но имеющие одинаковый заряд атомных ядер и поэтому занимающие одно место в периодической системе Менделеева. Атомы разных изотопов одного и того же хим. элемента отличаются по числу… … Геологическая энциклопедия
Изотопы — Isotopes нуклиды, имеющие одинаковый атомный номер, но различные атомные массы (например, уран 235 и уран 238). Термины атомной энергетики. Концерн Росэнергоатом, 2010 … Термины атомной энергетики
ИЗОТОПЫ — (от изо. и греч. topos место), элементы с одинаковым порядковым номером, но с разной атомной массой. Большинство радиоактивных изотопов, важных для экологии, обладают энергией от 0,1 до 5 Мэв (чем выше энергия радиоактивных изотопов, тем больше … Экологический словарь
изотопы — Нуклиды, имеющие одинаковый атомный номер, но различные атомные массы (например, уран 235 и уран 238). [http://pripyat.forumbb.ru/viewtopic.php?id=25] Тематики атомная энергетика в целом EN isotopes … Справочник технического переводчика
ИЗОТОПЫ — разновидности атомов данного хим. элемента, ядра которых содержат одинаковое число протонов, но различное число нейтронов. И. имеют разные атомные (см.) и одинаковое число электронов в атомной оболочке, что определяет их очень близкие физ. хим.… … Большая политехническая энциклопедия
Изотопы хлора
Изотопы хлора — разновидности атомов (и ядер) химического элемента Хлора, имеющие разное содержание нейтронов в ядре.
Таблица изотопов хлора
| Символ нуклида | Z(p) | N(n) | Масса изотопа [1] (а. е. м.) | Период полураспада [2] (T1/2) | Спин и чётность ядра [2] |
|---|---|---|---|---|---|
| Энергия возбуждения | |||||
| 28 Cl | 17 | 11 | 28,02851 | 1+ | |
| 29 Cl | 17 | 12 | 29,01411 | 20,0 нс | 3/2+ |
| 30 Cl | 17 | 13 | 30,00477 | 30 нс | 3+ |
| 31 Cl | 17 | 14 | 30,99241 | 150 мс | 3/2+ |
| 32 Cl | 17 | 15 | 31,985690 | 298,0 мс | 1+ |
| 33 Cl | 17 | 16 | 32,9774519 | 2,511 с | 3/2+ |
| 34 Cl | 17 | 17 | 33,97376282 | 1,5264 s | 0+ |
| 34m Cl | 146,36 кэВ | 32,00 мин | 3+ | ||
| 35 Cl | 17 | 18 | 34,96885268 | стабилен | 3/2+ |
| 36 Cl | 17 | 19 | 35,96830698 | 301 тыс. лет | 2+ |
| 37 Cl | 17 | 20 | 36,96590259 | стабилен | 3/2+ |
| 38 Cl | 17 | 21 | 37,96801043 | 37,24 мин | 2- |
| 38m Cl | 671,361 кэВ | 715,0 мс | 5- | ||
| 39 Cl | 17 | 22 | 38,9680082 | 55,6 мин | 3/2+ |
| 40 Cl | 17 | 23 | 39,97042 | 1,35 мин | 2- |
| 41 Cl | 17 | 24 | 40,97068 | 38,4 с | 1/2+ |
| 42 Cl | 17 | 25 | 41,97325 | 6,8 с | |
| 43 Cl | 17 | 26 | 42,97405 | 3,07 с | 3/2+ |
| 44 Cl | 17 | 27 | 43,97828 | 560 мс | |
| 45 Cl | 17 | 28 | 44,98029 | 400 мс | 3/2+ |
| 46 Cl | 17 | 29 | 45,98421 | 232 мс | |
| 47 Cl | 17 | 30 | 46,98871 | 101 мс | 3/2+ |
| 48 Cl | 17 | 31 | 47,99495 | 100 мс | |
| 49 Cl | 17 | 32 | 49,00032 | 50 мс | 3/2+ |
| 50 Cl | 17 | 33 | 50,00784 | 20 мс | |
| 51 Cl | 17 | 34 | 51,01449 | 2 мс | 3/2+ |
Примечания
Полезное
Смотреть что такое «Изотопы хлора» в других словарях:
Изотопы серы — разновидности атомов (и ядер) химического элемента серы, имеющие разное содержание нейтронов в ядре. Таблица изотопов серы Символ нуклида Z(p) N(n) Масса изотопа[1] (а. е. м.) Период полураспада … Википедия
изотопы — ов; мн. (ед. изотоп, а; м.). [от греч. isos равный и topos место] Спец. Разновидности одного и того же химического элемента, различающиеся массой атомов. Радиоактивные изотопы. Изотопы урана. ◁ Изотопный, ая, ое. И. индикатор. * * * изотопы (от… … Энциклопедический словарь
Изотопы — (от Изо. и греч. tópos место) разновидности одного химического элемента, занимающие одно место в периодической системе элементов Менделеева, но отличающиеся массами атомов. Химические свойства атомов, т. е. принадлежность атома к тому… … Большая советская энциклопедия
ИЗОТОПЫ — (от изо. и греч. topos место), нуклиды одного хим. элемента, т. е. разновидности атомов определенного элемента, имеющие одинаковый атомный номер, но разные массовые числа. Обладают ядрами с одинаковым числом протонов и разл. числом нейтронов,… … Химическая энциклопедия
ХЛОР — Cl (chlorum), химический элемент VII группы периодической системы элементов, член семейства галогенов (F, Cl, Br, I, At). Газообразный хлор выделил К.Шееле в 1774 по реакции соляной (хлороводородной) кислоты с пиролюзитом (MnO2), но не установил … Энциклопедия Кольера
Аргон — 18 Хлор ← Аргон → Калий … Википедия
ХЛОР — ХЛОР, С12, хим. элемент, порядковый номер 17, атомный вес 35,457. Находясь в VІI группе III периода, атомы хлора имеют 7 наружных электронов, благодаря чему X. ведет себя как типичный одновалентный металлоид. X. разделен на изотопы с атомными… … Большая медицинская энциклопедия
ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ — ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ, периодический закон. Уже с давних пор были делаемы попытки установить зависимость свойств элементов от их атомного веса: Деберейнер (Dobereiner, 1817) указал на триад ы подобных элементов, между атомными весами к… … Большая медицинская энциклопедия
КАЛЬЦИЙ — Ca (calcium), химический элемент, относится к семейству щелочноземельных металлов Be, Mg, Ca, Sr, Ba, Ra, составляющих IIA подгруппу периодической системы элементов. Открыт Х.Дэви в 1808. Кальций третий после алюминия и железа из наиболее… … Энциклопедия Кольера
Галогены — В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете … Википедия
Что называют изотопами запишите обозначения изотопов водорода хлора
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
Задание 1
Что общего у изотопов одного и того же элемента и чем они различаются?
Общее: заряд ядра атома, число протонов, число электронов.
Различное: число нейтронов и, соответственно, массовое число (или масса).
Задание 2
Запишите в символьном виде обозначения изотопов:
гелий ― 4 4 2He
азот ― 14 14 7N
фтор ― 19 19 9F
хлор ― 35 35 17Cl