Что называют электролитической диссоциацией физика 10 класс
Что называют электролитической диссоциацией физика 10 класс
Ключевые слова конспекта: электролитическая диссоциация, теория, электролиты, неэлектролиты, определения основаниям, кислотам и солям как электролитам, степень диссоциации, степень электролитической диссоциации.
ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
Электрический ток – это направленное движение заряженных частиц. В металлах такое направленное движение осуществляется за счёт относительно свободных электронов. Но проводить электрический ток могут не только металлы.
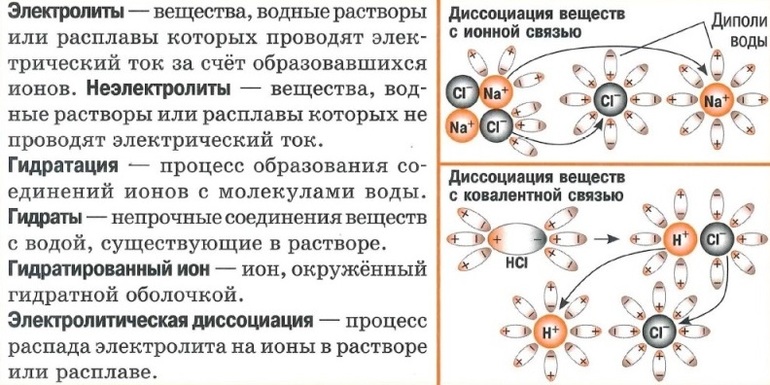
Вещества, растворы или расплавы которых проводят электрический ток, называются электролитами. Вещества, растворы или расплавы которых не проводят электрический ток, называются неэлектролитами.
Почему же электролиты проводят электрический ток?
В 1887 г. шведский учёный Сванте Аррениус сформулировал положения теории электролитической диссоциации. Основная идея этой теории заключается в том, что электролиты под действием растворителя самопроизвольно распадаются на ионы. Электропроводность электролитов обусловлена именно наличием в растворе свободных ионов, которые и являются носителями зарядов.
В дальнейшем теория электролитической диссоциации совершенствовалась. Современная теория водных растворов электролитов, кроме теории С. Аррениуса, включает в себя представления о гидратации ионов (И. А. Каблуков, В. А. Кистяковский) и теорию сильных электролитов (П. Й. Дебай, Э. А. Хюккель, 1923 г.).
Основными положениями теории электролитической диссоциации являются следующие:
ОПРЕДЕЛЕНИЯ ОСНОВАНИЙ, КИСЛОТ И СОЛЕЙ
В свете теории электролитической диссоциации можно дать определения основаниям, кислотам и солям как электролитам.
Основания – это электролиты, в результате диссоциации которых в водных растворах образуется только один вид анионов – гидроксид-анионы OH – :
КОН = К + + OH –
Са(ОН)2 = Са 2+ + 2 OH –
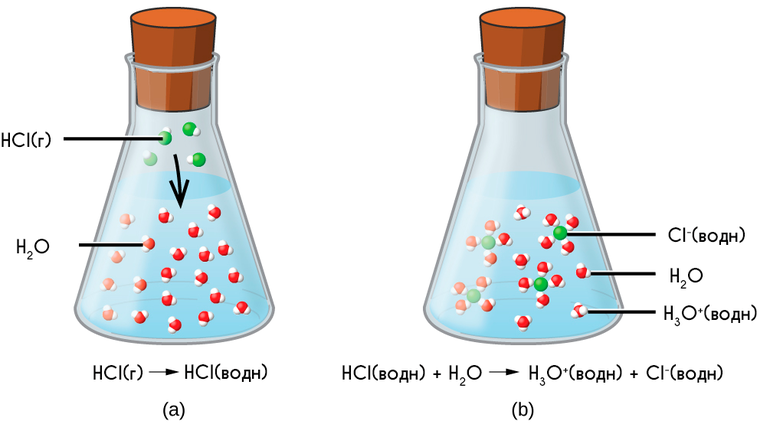
Кислоты – это электролиты, в результате диссоциации которых в водных растворах образуется только один вид катионов – катионы водорода Н + (точнее – катионы гидроксония H3O + ).
Катион гидроксония образуется при взаимодействии Н + с молекулой H2O. В результате образуется ещё одна ковалентная связь кислорода с водородом по донорно-акцепторному механизму:
Примеры диссоциации кислот:
НCl = Н + + Cl – или НCl + H2O = H3O + + Cl –
НСlO4 = Н + + СlO4 – или НСlO4 + H2O = H3O + + СlO4 –
Многоосновные кислоты диссоциируют ступенчато:
Соли – это электролиты, диссоциирующие в водном растворе на катионы металлов и анионы кислотного остатка.
Средние соли диссоциируют с образованием только катионов металла и анионов кислотного остатка. Например:
Соли аммония вместо катиона металла содержат катион аммония. Например:
NH4Cl = NH4 + + Cl –
Основные соли диссоциируют с образованием катионов металла, анионов ОН– и анионов кислотного остатка:
Суммарное уравнение: AlOНCl2 = Al 3+ + ОН – + 2Cl –
Кислые соли диссоциируют с образованием катионов металла, катионов водорода (гидроксония) и анионов кислотного остатка. Например:
Суммарное уравнение: Са(НСO3)2 + 2H2O = Са 2+ + 2H3O + + 2СО3 2–
Двойные соли – соли, в результате диссоциации которых образуются катионы нескольких металлов (или аммония и какого–либо металла) и анионы одного кислотного остатка. Например, сульфат калия–хрома (хромокалиевые квасцы):
Смешанные соли – соли, в результате диссоциации которых образуются катионы какого-либо металла и анионы нескольких кислотных остатков. Например, хлорид-гипохлорит кальция (хлорная известь):
СаСlOCl = Са 2+ + Cl – + СlO –
При растворении одних электролитов диссоциация происходит практически полностью. Такие электролиты называют сильными. При растворении других электролитов диссоциация происходит в незначительной мере, их называют слабыми.
СТЕПЕНЬ ДИССОЦИАЦИИ
Для количественной оценки силы электролита введено понятие степени электролитической диссоциации.
Степень электролитической диссоциации (α) – отношение количества вещества электролита, распавшегося на ионы (nрасп.), к количеству вещества электролита, поступившего в раствор (nобщ.):
Степень диссоциации также выражают в процентах, тогда 0%
Конспект урока «Электролитическая диссоциация. Степень диссоциации».
Электролитическая диссоциация
Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем лучше оно проводит электрический ток и является более сильным электролитом.
В общем виде процесс электролитической диссоциации можно представить так:
Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы и H другой молекулы.
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4, H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:
Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы. Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:
Для средних солей диссоциация чаще всего происходит в одну ступень:
Из одной молекулы ортофосфата натрия образовалось 4 иона.
Из одной молекулы сульфата калия образовалось 3 иона.
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности, вещества делятся на электролиты и неэлектролиты.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят электрический ток.
Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми наиболее часто пользуемся. Примеры молекулярных уравнений:
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Электролитическая диссоциация
Химия
Именная карта банка для детей
с крутым дизайном, +200 бонусов
Закажи свою собственную карту банка и получи бонусы
План урока:
Наверняка Вы замечали, что некоторые вещества «дружат» с водой и растворяются в ней. Другие совсем наоборот – совсем нерастворимы. С чем это связано? Чтобы ответить на данный вопрос, давайте вспомним тип химической связи, который характерный для этого вещества.
Молекула воды состоит из двух элементов – кислород и водород, между которыми возникает ковалентная полярная связь. Не стоит также забывать о существовании водородной связи между молекулами. Строение молекулы воды можно изобразить с помощью схемы.
Кластеры представляют собой соединённые молекулы воды между собой. Существует гипотеза, что вода обладает памятью, т.е. несёт информацию.
Вот эти ячейки, по мнению некоторых учёных, несут информацию.
Наличие диполя даёт право говорить, что Н2О растворитель для полярных веществ.
У химиков существует правило: подобное растворяется в подобном. Накрасив ногти лаком, Вы не сможете его смыть водой. На помощь Вам приходит жидкость для снятия лака, в составе которого содержится малополярный растворитель – ацетон. А, чтобы получить пользу от морковки в виде витаминаА, необходимо к ней добавить жир. Потому что этот витамин, как впрочем и витамины E, D, F и К, относятся к жирорастворимым.
Существуют неполярные и полярные растворители. Список неполярных растворителей возглавляют жиры, керосин и бензин. Ко вторым относят воду. К малополярным растворителям относят ацетон.
Как выше было сказано, молекула воды имеет строение диполь, это означает, что имеет противоположные заряды – положительный и отрицательный. При её «встрече» с полярными веществами происходит процесс растворения.
Процесс растворения веществ в воде
Доказательством того, что растворение это физический процесс служит то, что смесь возможно разделить путём выпаривания. После растворения соли в воде температура раствора становится ниже, это признак химической реакции. Таким образом, растворение – это физико-химический процесс.
Следовательно, вода действует на структуру вещества и разрушает её, образуя при этом раствор.
Растворимость твёрдых веществ зависит от их природы, точнее от типа химической связи и кристаллической решётки. Вода будет растворять вещества с сильнополярной (ионной) связью, в узлах которых находятся молекулы или ионы. Оксиды элементов IV группы углекислый газ и оксид кремния имеют одинаковый тип химической связи – это ковалентная полярная, однако различны по строению решётки. СО2 имеет молекулярную, а SiO2– атомную. Поэтому эти два вещества имеют разные свойства и растворимость. А именно, оксид кремния не растворяется в воде.
Также существует зависимость растворимости от температуры. Чем она выше, тем растворимость веществ будет лучше. Наглядно эту закономерность вы наблюдаете, когда пьёте чай, в горячей воде сахар быстрее растворяется. Однако для газов это правило играет противоположную роль, они лучше растворяются при понижении температуры.
Растворимость веществ неодинаковая. Принято делить вещества на три типа.
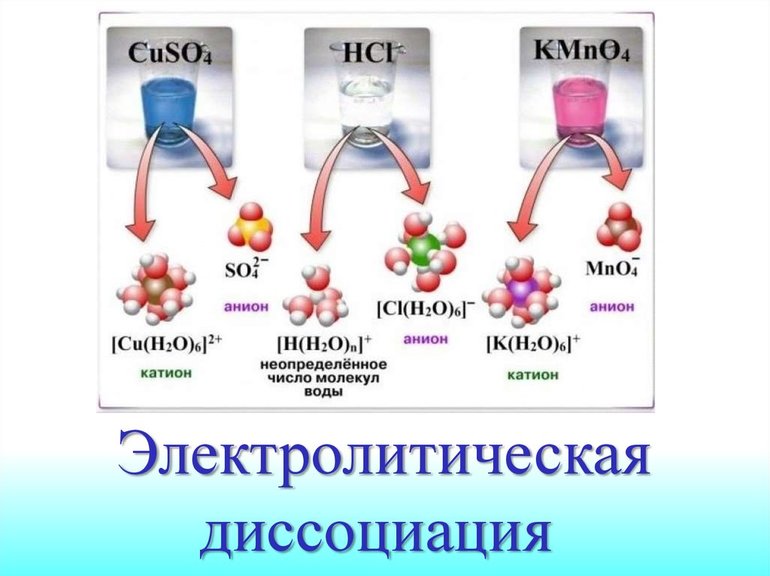
В кабинете химии, рядом с периодической системой, находится ещё одна важная таблица – это таблица растворимости веществ, которую также можете найти в любом справочном материале химии. Каждое вещество представлено в виде катиона и аниона. Как они образуются? Даст ответ на этот вопрос теория, созданная шведским учёным Аррениусом.
Теория электролитической диссоциации
Вернёмся к раствору, который состоит из хлорида натрия и воды. Если взять отдельно два этих вещества и каждое проверить на электропроводность, то результат будет отрицательный – они не проводят ток. Однако смесь этих веществ – раствор,будет электропроводный, т.е. являться электролитом.
Как Вам известно, с курса физики, электрический ток – это поток заряженных частиц. Однако, откуда они берутся? При растворении образуются ионы, которые и будут причиной электропроводности.
Т.е. диссоциацию хлорида натрия можно записать в следующем виде:
Рассмотрим, как происходит диссоциация веществ с ионным типом связи. Данный тип локализуется в солях и основаниях.
Рассмотрим NaOH, Ba(OH)2, Fe(OH)3. Из них NaOHи Ва(ОН)2 относятся к щелочам (растворимые) основания и Fe(OH)3, который является нерастворимым. Если соединениене способно раствориться в воде, то такой раствор не будет проводить электрический ток. Молекула воды не может разрушить кристаллическую решётку, поэтому ионы не образуются и эти вещества неэлектролиты.
Раствор гидроксида натрия и гидроксида бария считаются электролитами, так как они диссоциируют на ионы. Следует обратить внимание, чтобы записать уравнение диссоциации оснований, запишем металл (указав его степень окисления) и гидроксильную группу, которая всегда имеет заряд минус 1. Число гидроксильных групп указываем коэффициентом.
Соли в воде распадаются на ионы металла и кислотного остатка. Как и в случае с основаниями, записываем: металл плюс кислотный остаток. Предварительно смотрим в таблицу растворимости, где можем уточнить заряд кислотного остатка и металла, а также проверить растворимость вещества.
Рассмотрим, как происходит диссоциация кислот, на примере соляной кислоты.
Для этого соединения характерна ковалентная полярная связь. Водород имеет положительный заряд, хлор – отрицательный.
Также следует обратить внимание, что молекула изначально нейтральное вещество. При написании уравнения, необходимо смотреть, чтобы количество положительных и отрицательных зарядов было равно.
Диссоциация электролитов имеет количественную характеристику.
Степень диссоциации зависит от следующих параметров:
Сила электролита определяется числом молекул, которые продиссоциировали. Чем выше это число, тем сильнее будет электролит.
Соответственно, электролитом является вещество с ионным или ковалентным типом связи. Его сила будет зависеть от природы вещества.
Обобщим всё выше сказанное, попробуем вывести положения теории электролитической диссоциации. Первый пункт можно записать в следующем виде.
Если же к электролитам относятся растворимые соли, кислоты и основания, рассмотрим, на какие частицы они будут диссоциировать.
Второй пункт даст ответ на вопрос, что является причиной диссоциации.
Если же через растворы электролитов пропустить электрический ток, то ионы принимают упорядоченное движение. Третий постулат звучит так.
Каждое вещество индивидуально, имеет определённый качественный и количественный состав, а также отличается строением. Именно по этой причине молекулы веществ в водном растворе могут распадаться полностью на ионы или частично. Выделим 4 пункт.
Каким образом мы можем прогнозировать силу электролитов. Если в случае солей и оснований достаточно посмотреть в таблицу растворимости, растворимые вещества это сильные электролиты, то в случае кислородсодержащих кислот этого будет недостаточно. К примеру, угольная кислота Н2СО3 по данным таблицы растворимости, относится к растворимым веществам, однако она считается слабым электролитом. Сера образует кислоты H2SO3 и H2SO4, одна из которых считается сильной кислотой, а вторая – слабой. Чтобы предположить силу кислот используем правила.
Из этого следует, что серная кислота – это сильный электролит, сернистая кислота относится к слабым электролитам.
Теория электролитической диссоциации
Что такое электролитная диссоциация? В следствие чего она образуется и какие факторы влияют на ее степень? Как научиться составлять уравнения диссоциации?
Кто открыл способность некоторых растворов проводить электрический ток и почему великий русский химик Д.И.Менделеев не получил Нобелевской премии?
Ответы на все эти вопросы вы узнаете из этой статьи.
История вопроса
Изучение растворов с давних времен занимало умы исследователей. В начале XIX века М. Фарадей открыл способность некоторых растворов проводить электрический ток. Геймгольц, немецкий физик, предположил, что электролиты в растворе полностью распадаются на ионы, то есть существует электролитическая диссоциация. Однако увеличение электропроводности с уменьшением концентрации раствора объяснить не смог.
Ученые заметили, что растворы замерзают при более низкой температуре, чем чистые растворители. Именно этим свойством растворов и в наше время пользуются дворники, щедро посыпая солью обледеневшие тротуары. Однако, температура замерзания электролитов не соответствовала расчетным данным.
Научным несостыковкам требовалось найти объяснение. И молодой, 29-летний шведский ученый С. Аррениус, в 1887 г. исследуя проведение электрического тока в растворах различных веществ, выдвинул теорию, которая могла объяснить эти факты.
Основные положения теории электролитической диссоциации
Степень диссоциации
В ходе научных исследований ученые определили, что в растворе диссоциирует некоторая часть молекул растворителя. Для количественной характеристики силы электролита был введен показатель степени диссоциации, который обозначается α и рассчитывается по формуле
Где ν — количество вещества, распавшееся на ионы,
ν0 — общее количество вещества.
Степень диссоциации также можно выразить в процентах. Как это сделать, можно узнать в § 11 учебника «Химия. 9 класс» под редакцией В.В. Еремина.
В зависимости от степени диссоциации вещества делят на сильные и слабые электролиты.
Сильные электролиты представляют собой вещества, которые в разбавленных растворах практически полностью распадаются на ионы. Степень диссоциации более 0.5, или 50%.
Для слабых электролитов значение степени диссоциации α меньше 0.1, или 10%.
Вещества с промежуточными значениями от 10 до 50% иногда называют средними электролитами.
Уравнение диссоциации
Уравнение электролитической диссоциации используют для записи процессов, происходящих в растворе.
Диссоциация сильного электролита протекает практически необратимо, что показывает стрелка →.
Диссоциация слабого электролита — обратимый процесс, протекает не полностью и не до конца, что обозначает стрелка ⇄
Умение составлять уравнения диссоциации будет отличным подспорьем при разборе темы «§ 13. Реакции ионного обмена и условия их протекания» в учебнике «Химия. 9 класс» под редакцией В.В. Еремина и для решения ионных уравнений.
Противостояние титанов
Теория электролитической диссоциации Аррениуса вызвала жаркие споры среди ученых.
Химический мир разделился на два лагеря. Сторонники «физической» теории Аррениуса считали, что распад на ионы происходит без какого-либо воздействия сил внешней среды и раствор представляет собой механическую взвесь ионов и молекул воды.
Но эта теория не могла объяснить тепловые эффекты при растворении. Например, нагревание колбы при разведении в воде серной кислоты или покрытие сосуда инеем при растворении в воде аммиачной селитры или азотнокислого аммония.
Сторонники «химической», или гидратной, теории, автором которой был Д.И. Менделеев, считали, что в растворе происходит взаимодействие растворенного вещества и растворителя.
Много копий было сломано в этой борьбе. Проявились худшие человеческие качества. Так, Аррениус, пользуясь служебным положением (в 1905 году он был назначен директором физико-химического Нобелевского института в Стокгольме), приложил массу усилий, чтобы, несмотря на трехкратную номинацию на получение Нобелевской премии в 1905, 1906 и 1907 годах, Д.И. Менделеев так ее и не получил.
Но истина, как всегда, оказалась посередине: в ходе дальнейших экспериментов ученые выяснили, что растворитель и растворенное вещество, взаимодействуя между собой, дают необходимую энергию для разрушения кристаллической решетки электролитов. В споре великих умов родилась новая протолитическая, или протонная, теория кислот и оснований.
Электролитическая диссоциация
К соединениям, что отлично пропускают через себя ток, причисляют сильные кислоты, основания и соли, способные активно растворяться в H2O. Примеры веществ, водные соединения которых не в состоянии проводить электрический ток:
Причина электропроводности открыта в 1877 году шведским учёным С. Аррениусом. Он долго изучал свойства разнообразных соединений и наконец обнаружил, что в некоторых из них наличествуют ионы. Именно они проводят электрический ток. Частицы образуются, когда в воде растворяются определённые ингредиенты. Этот процесс называется электролитической диссоциацией.
С. Аррениус полагал, что частицы изначально находятся в растворах. Он не учитывал, что при взаимодействии электролита и воды происходит химическая реакция. Пытаясь объяснить процесс диссоциации, этот учёный опирался на физическую теорию растворов.
В отличие от него, русские физикохимики Вадимир Александрович Кистяковский и Иван Алексеевич Каблуков применили подход Д. И. Менделеева. Опираясь на химическую теорию, они сумели разработать доказательство того, что реакция является ступенчатой. Когда компонент растворяется в воде, сначала образуются гидраты. Следующая ступень — высвобождение ионов. Атомы водорода в молекуле воды расположены под углом 104,5°. При этом они как бы окутывают элемент, который впоследствии переходит в свободное состояние.
Обратимость реакции
Вещества, имеющие ионную кристаллическую решётку, диссоциируют активнее. Они уже состоят из мельчайших элементов, среди которых есть положительно и отрицательно заряженные. Молекула воды представляет собой диполь — 2 противоположно заряженных полюса. К ним притягиваются частицы вещества при растворении. Одновременно ослабевают связи в кристаллической решётке. Кристалл распадается и раствор насыщается элементами. Схематично процесс электролитической диссоциации можно представить так:
Диссоциация электролитов, состоящих из молекул с ковалентной связью, происходит аналогично. Диполи воды оказывают влияние на молекулы вещества. При этом ковалентная связь преобразуется в ионную. Механизм диссоциации выглядит так:
В естественных условиях частицы в растворе перемещаются хаотично. При этом некоторые из них сталкиваются и объединяются. Такой процесс называется ассоциацией. Отображая эти реакции в виде формулы или уравнения электролитической диссоциации, ставят знак обратимости. Он показывает, что противоположно направленные реакции происходят одновременно. Гидроокиси, обладающие подобным свойством, называют амфотерными.
Некоторые слабые электролиты диссоциируют обратимо и ступенчато. К таким относятся угольная и сероводородная кислоты, гидроксид магния. Гидратированные и негидратированные частицы имеют разные свойства. Например, подвергаясь гидратации, катион или анион меди приобретает голубой цвет. Будучи негидратированным — белый.
В гидратированном элементе количество молекул воды может быть как постоянным, так и изменчивым.
Определение степени
В водном растворе вещества одновременно присутствуют ионы и молекулы. Их количество различается. Для понимания, сколько частиц в растворе в текущий момент, в химии стали использовать специальный показатель — степень диссоциации. Его принято обозначать буквой «альфа» (a). Определение этого показателя выглядит так: с. д. — это отношение ионов к общему количеству частиц, растворившихся в жидкости. Степень д. выражается в процентах (%) или долях.
Когда a=100% или 1, это означает, что электролит целиком распался на ионы. Если a=0, реакция отсутствует. Степень диссоциации неодинакова у разных жидкостей. Она обусловлена тем, каким свойствами обладает электролит изначально. Также интенсивность распада обусловлена тем, сколько в растворе электролита и воды. Чем концентрированнее соединение, тем ниже показатель степени, и наоборот.
Типы электролитов
По способности диссоциировать на ионы жидкости с электролитическим компонентом делят на сильные и слабые. К первым относят те, что полностью вступают в реакцию. Их степень диссоциации равна единице или 100%. Список электролитов, относящихся к сильным:
У слабых электролитов показатель степени диссоциации почти всегда минимален или стремится к нулю. Такие вещества практически не распадаются на элементарные частицы. Категории соединений, отнесённых к слабым электролитам:
Динамическое равновесие
Слабые электролиты диссоциируют не полностью. Когда они находятся в растворе, процесс диссоциации происходит до определённого момента, потом прекращается. Устанавливается динамическое равновесие. Это явление можно выразить в виде уравнения. Способность вещества диссоциировать на мельчайшие частицы называют константой диссоциации или равновесия.
Чем активнее электролит образует ионы, тем он сильнее, а значит, константа выше. У слабых этот показатель будет ниже. Значения констант диссоциации для разных элементов, из которых состоит таблица Менделеева, приводятся в справочной литературе. Эти показатели применимы только к водным растворам. В неводных химические элементы ведут себя иначе.
Кроме воды, вещества могут растворяться в ацетоне, эфире, бензоле, спирте и многих других жидкостях.
Основные положения теории
Электролитической диссоциации посвящена научная теория, состоящая из 5 постулатов. Первый гласит, что электролиты, растворяясь в воде, распадаются на 2 категории ионов — положительно и отрицательно заряженные. Этот вид частиц представляет собой одну из форм, в которой может существовать химический элемент.
Свойства атомов и ионов различаются. Например, ионы натрия не образуют соединений с водой, а атомы этого же элемента вступают с ней в реакцию. Результатом взаимодействия становятся водород и щёлочь. Атомы и ионы хлора различаются по свойствам: первые токсичны, окрашены в жёлто-зелёный цвет и издают резкий запах, а вторые не пахнут, бесцветны и неядовиты.
Когда один или группа атомов присоединяют или отдают электроны, образуются ионы, несущие отрицательный или положительный заряд. По составу они подразделяются на простые и сложные. Находясь в растворе, эти частицы хаотично и непрерывно движутся.
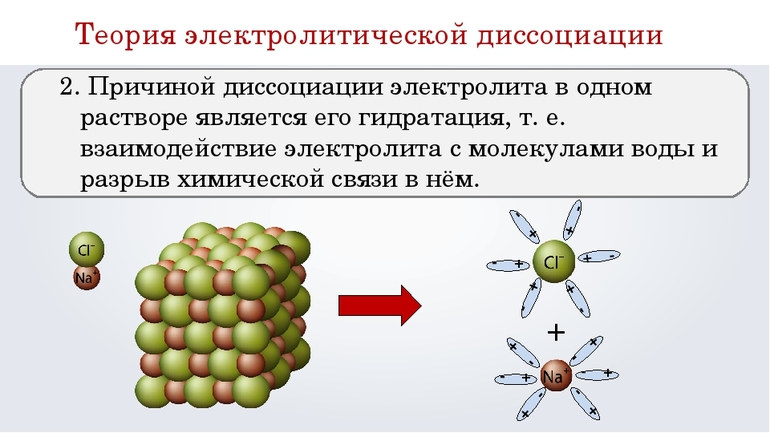
Суть следующего положения теории заключается в том, что причиной диссоциации является взаимодействие молекул воды и электролита, сопровождающееся разрывом химической связи в последнем. В результате гидратации образуются ионы, связанные с молекулами H2O. По-другому эти частицы называют гидратированными. От негидратированных их отличает наличие водной оболочки.
Третье положение объясняет, как образуются катионы и анионы. Под воздействием электротока отрицательные ионы перемещаются к аноду. Он представляет собой положительный полюс. Эти ионы называют анионами.
Положительно заряженные частицы движутся к катоду — отрицательному полюсу источника электротока. Эти частицы называются катионами. Таким образом, ионы могут классифицироваться по знаку заряда. Растворы электролитов всегда электронейтральны, потому что суммы зарядов катионов и анионов равны.
Согласно четвёртому положению теории, электролитическая диссоциация, происходящая с участием слабых электролитов, является обратимым процессом. Одновременно с распадом вещества на ионы происходит соединение последних.
Согласно пятому положению, степень электролитической диссоциации отличается у разных элементов. Она зависит от природы вещества и его концентрации в растворе.
Ионный обмен
В процессе распада кристаллической решётки образуются ионы и молекулы. Состояние, в котором они пребывают, называют динамическим равновесием. Жидкость, содержащая растворившийся сильный электролит, имеет свойства, обусловленные ионами, а та, в которой присутствует слабый, — ещё и молекулами. Например, уксусная кислота обладает характерными вкусом и запахом. Первое свойство объясняется присутствием ионов, второе — содержанием молекул.
Есть ряд характеристик, общих для всех растворов, содержащих сильный электролитический компонент. Так, щёлочи мыльные на ощупь, при этом они способны изменять цвет индикаторов. Эти характеристики объясняются наличием гидроксид-ионов. Растворимые соли приобретают свои характеристики в связи с тем, что в растворенном виде они распадаются на анионы и катионы. Идентичные характеристики кислот обусловлены тем, что в их составе присутствуют ионы оксония H3O.
Некоторые реакции в электролитных растворах протекают с высокой скоростью. Это обусловлено тем, что в них участвуют ионы. Формулы, описывающие эти процессы, называют ионными. Так же именуют и реакции, при этом их классифицируют на обратимые, протекающие до конца, и необратимые. Во втором случае процесс одновременно протекает в прямом и обратном направлениях. Когда ионы вступают в необратимую реакцию, они соединяются и образуют следующие типы элементов и соединений:
Будет ли реакция обратимой, зависит от того, какие химические элементы есть среди исходных. Если это малорастворимые компоненты или слабые электролиты, диссоциация протекает одновременно с ассоциацией. Следовательно, наблюдается обратимое явление. Для него характерно смещение равновесия. Образуется слабый электролит, при этом остаются гидроксид-ионы и недиссоциированные молекулы.
Если исходные компоненты представляют собой сильные электролиты, диссоциация не происходит. При взаимодействии образуется смесь ионов, при этом реакция не протекает. Сильные электролиты не образуют газов, малодиссоциирующих или нерастворимых веществ. Сколько и какого вещества образуется в результате реакции, определяют с помощью уравнений. Например, при распаде 1 моль нитрата аммония возникает 2 моль анионов и катионов.