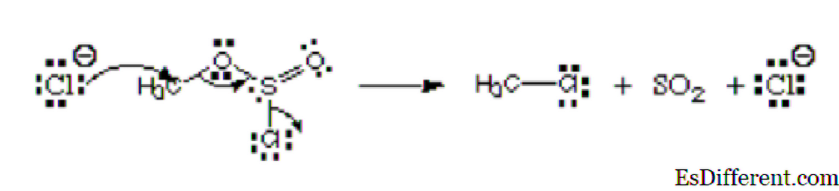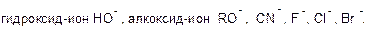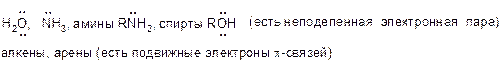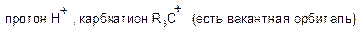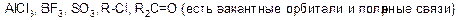Что называют электрофилами и нуклеофилами приведите их примеры
Электрофильные и нуклеофильные 2021
Электрофилы и нуклеофилы являются двумя важными понятиями в органической химии, которые помогают описать химические реакции между акцепторами электронов и донорами. Эти два термина были введены в 1933 году Кристофером Келком Ингольдом, и они служили заменой для катионидных и анионоидных терминов, которые были введены в 1925 году А.J. Lapworth.
С тех пор были проведены обширные исследования для понимания различий между электрофилом и нуклеофилом. Эта статья демистифицирует разницу между этими двумя концепциями. В двух словах нуклеофил является донором электронов, тогда как электрофил является акцептором электронов.
Что такое электрофил?
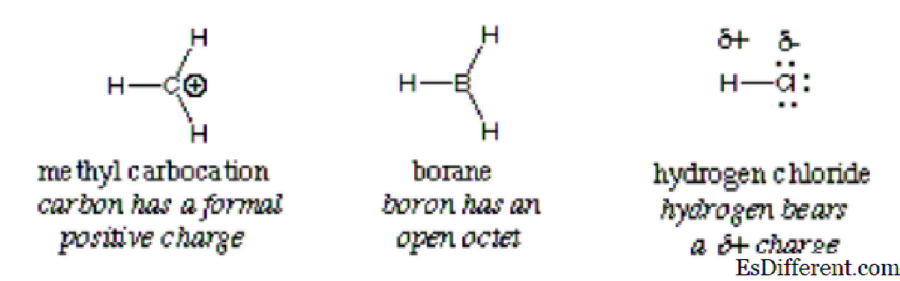
Для разбивки термина слово «электро» происходит от электронов, а латинское слово «филе» относится к «любящему». Проще говоря, это означает, что они любят электроны. Это реагент, который характеризуется низкой плотностью электронов в его валентной оболочке и, следовательно, реагирует с молекулой высокой плотности, ионом или атомом с образованием ковалентной связи. Ион водорода в кислотах и метилкарбокация являются примерами электрофильных веществ. Они являются электронно-дефицитными.
Электрофил легко обнаруживается положительным зарядом или нейтральным зарядом с пустыми орбиталями (не удовлетворяющими правилу октета). Электроны перемещаются из области высокой плотности в ту, с низкой плотностью, и в отличие от зарядов притягивают друг друга. Эта теория объясняет притяжение электронов электронно-дефицитными электрофильными атомами, молекулами или ионами. По определению, электрофил взаимозаменяемо называют кислотой Льюиса, поскольку он принимает электроны в соответствии с определением кислоты.
В приведенной ниже реакции и соединениях приведены примеры электрофилов:
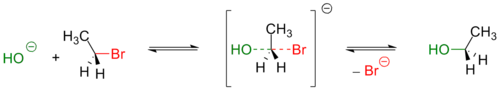
В этой реакции ион гидроксида реагирует с хлористым водородом; таким образом, кислота реагирует с основанием. Как указано стрелкой, чем более электроотрицательный атом кислорода подает электроны на электронно-дефицитный атом водорода. Он разделяет одиночную пару с атомом водорода, который несет положительный заряд в составном хлориде водорода, потому что он более электроотрицателен, чем водород. Эта реакция является фундаментальной из многих реакций органической химии, в частности реакций Льюиса и Льюиса. Другие примеры изображены на следующем рисунке:
В общем случае электрофил идентифицирован частичным положительным зарядом, как в хлористом водороде, формальный положительный заряд, как в метилкарбокации или свободных орбиталях. Типичными примерами электрофилов являются поляризованные нейтральные молекулы, такие как ацилгалогениды, карбонильные соединения и алкилгалогениды.
Важный: Ион Hydronium, хотя и имеет положительный заряд, не может быть классифицирован как электрофильный из-за полных свободных орбиталей в его внешней оболочке. Он дает водород и воду. То же самое касается иона аммония; он не имеет свободных орбиталей, которые могут привлекать электроны. В результате он не является электрофилом.
Что такое нуклеофил?
Этот термин разбит на слово «нуклео», которое относится к ядру и латинское слово «phile», что означает любовь. Это просто означает, что ядро любит. Нуклеофилы богаты электронами и, таким образом, передают электронные пары электрофилам для образования ковалентных связей в химических реакциях. Эти вещества лучше всего замечаются одиночными парами, пи-связями и отрицательными зарядами. Ионы аммония, иодида и гидроксида являются примерами нуклеофильных веществ.
По определению, нуклеофил взаимозаменяемо называют основой Льюиса, потому что все они жертвуют электроны и принимают протоны. На рисунке ниже показаны примеры нуклеофилов:
Нуклеофильный центр в соединении обнаруживается с наиболее электроотрицательным атомом. Рассмотрим аммиак NH3; азот является более электроотрицательным и, таким образом, направляет электроны в центр. Соединение обладает высокой электронной плотностью и, при взаимодействии с электрофилом, скажем, в воде, оно жертвует электроны. ЧАС2O может действовать как электрофил или нуклеофил в зависимости от соединения или молекулы, с которой он реагирует.
Рассмотрим рисунок ниже:
Из рисунка первый атом, хлорид-ион, переносит свою одинокую пару на углерод с образованием ковалентной связи. Он имеет отрицательный заряд и жертвует электроны, и поэтому он рассматривается как нуклеофил. Этот атом хлора, который покидает сложный эфир хлорсульфита, называется уходящей группой. Это не электрофил или нуклеофил.
Основное различие между электрофилом и нуклеофилом
Определение электрофила и нуклеофила
Электрофил представляет собой кислоту Льюиса, которая принимает электроны от богатого электронами атома, иона или молекулы. Принимая электроны, он образует ковалентную связь. Этот реагент часто идентифицируется частичным положительным зарядом, формальным положительным зарядом или нейтральным атомом, ионом или молекулой, который не удовлетворяет правилу октета. С другой стороны, нуклеофил представляет собой атом, ион или молекулу с высокой плотностью электронов. Он подает одиночную пару электрофилу с образованием ковалентной связи. Он идентифицируется положительными зарядами и свободными электронами на его орбите.
Химические реакции электрофила и нуклеофила
Нуклеофил участвует в нуклеофильном замещении и добавлении, тогда как электрофил участвует в электрофильном замещении и добавлении.
Идентификация заряда в электрофиле и нуклеофиле
Электрофил может быть нейтрально или положительно заряжен, тогда как нуклеофил может быть нейтрально или отрицательно заряжен.Электрофил принимает электроны, поэтому он упоминается как кислота Льюиса, тогда как нуклеофил жертвует электронами, поэтому он упоминается как основание Льюиса.
Разница между электрофилом и нуклеофилом
Химические реакции между органическими и неорганическими химическими веществами в основном происходят через электрофилы и нуклеофилы. Электрофилы и нуклеофилы могут быть определены как производные ат
Содержание:
Ключевые области покрыты
1. Что такое электрофил
— определение, характеристики, примеры
2. Что такое нуклеофил
— определение, характеристики, примеры
3. В чем разница между электрофилом и нуклеофилом
— Сравнение основных различий
Ключевые слова: электрофил, электрофильность, реакция электрофильного присоединения, реакция электрофильного замещения, нуклеофил, нуклеофильность, реакция нуклеофильного присоединения, реакция нуклеофильного замещения, кислота Льюиса, основание Льюиса
Что такое электрофил
Электрофилы называются Кислоты Льюиса из-за их способности принимать электроны. Электрофил создается, когда у атома или молекулы не хватает электронов, чтобы подчиняться правилу октетов или иметь положительный заряд, который необходимо нейтрализовать, чтобы стать стабильным.
В органической химии электрофилы подвергаются реакции присоединения и замещения. Например, добавление галогенов к алкенам происходит посредством реакций электрофильного присоединения.
Рисунок 01: Добавление алкена и брома
Реакции электрофильного замещения включают замещение электрофилом, замещающим функциональную группу молекулы. Чаще всего реакции с электрофильным замещением можно наблюдать с бензолом.
Рисунок 02: Электрофильное замещение электрофила на бензол, заменив атом водорода.
Сила электрофила определяется его электрофильностью. электрофильность это термин, используемый для обозначения электрофильной природы электрофилов. Эта электрофильность зависит от таких факторов, как заряд электрофила.
Что такое нуклеофил
Нуклеофилы обычно заряжены отрицательно. Даже нейтрально заряженные молекулы с богатыми электронами атомами могут вести себя как нуклеофилы. Нуклеофилы также показывают специфические реакции, такие как нуклеофильное присоединение и реакция нуклеофильного замещения.
Рисунок 03: Реакция между нуклеофилом и электрофилом
Приведенный выше пример показывает реакцию между нуклеофилом и электрофилом. Здесь, H2Молекула О действует как нуклеофил. Он отдает электроны карбокатиону, который имеет положительный заряд.
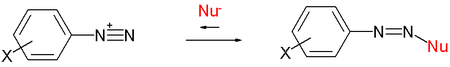
Рисунок 04: Нуклеофильное замещение
На изображении выше показана реакция нуклеофильного замещения. Нуклеофил обозначен как «Nu», а функциональная группа «X» в бензольном кольце заменена на нуклеофил. Затем нуклеофил присоединяется к бензольному кольцу, в то время как группа «X» покидает бензольное кольцо. Поэтому «Х» называется уходящей группой.
Нуклеофильность является важным термином в отношении нуклеофилов. Нуклеофильность определяет силу конкретного нуклеофила. Эта нуклеофильность зависит от многих факторов, таких как заряд, основность, поляризуемость и т. Д.Например, когда отрицательный заряд нуклеофила увеличивается, нуклеофильность увеличивается. Это означает, что нуклеофилы с высоким отрицательным зарядом действуют как превосходные нуклеофилы.
Разница между электрофилом и нуклеофилом
Определение
Электрический заряд
электрофил: Электрофилы заряжены положительно или нейтрально.
нуклеофил: Нуклеофилы заряжены либо отрицательно, либо нейтрально.
Химические реакции
электрофил: Электрофилы подвергаются реакциям электрофильного присоединения и электрофильного замещения.
нуклеофил: Нуклеофилы подвергаются реакциям нуклеофильного присоединения и нуклеофильного замещения.
Другие имена
электрофил: Электрофилы также называют кислотами Льюиса.
нуклеофил: Нуклеофилы также называют базами Льюиса.
Заключение
Рекомендации:
1. «Нуклеофил». Химия LibreTexts. Libretexts, 21 июля 2016 г.
Нуклеофилы и электрофилы



Понятие кислоты и основания очень близко к понятиям электрофил и нуклеофил, которые широко используются в органической химии для обозначения характера реагирующих частиц.
Нуклеофил – это частица с электронодонорными свойствами, способная образовать связь со своим партнером в реакции (электрофилом), отдавая неподеленую электронную пару или пару связи. Нуклеофилы являются основаниями Льюса.
а) отрицательно заряженные:
Электрофил – это частица с электроноакцепторными свойствами, которая образует связь со своим партнером в реакции (нуклеофилом). У электрофила должна быть вакантная орбиталь или сильнополярная связь. Электрофилы являются кислотами Льюса.
а) положительно заряженные:
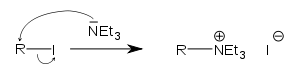
Для того чтобы прошла гетеролитическая реакция, нужны два реагента – нуклеофильный (донор электронов) и электрофильный (акцептор электронов).
Нуклеофил
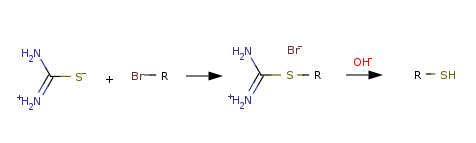
Амбидентные нуклеофилы имеют два и более реакционных центра. К примеру, тиоцианат-ион SCN − может атаковать электрофил либо атомом серы, либо атомом азота. Реакции галогеноалканов с SCN − часто приводят к образованию смеси RSCN (алкилтиоцианата) и RNCS (алкилизотиоцианата).
Содержание
Примеры
В данной реакции атака нуклеофила происходит со стороны, противоположной уходящей группе. Вследствие этого SN2-процессы сопровождаются обращением (инверсией) конфигурации.
Классификация
Нуклеофилы можно классифицировать несколькими способами: по типу орбитали, с которой донируются электроны, и по природе атома, который образует связь.
По типу реагирующей орбитали
В зависимости от природы орбитали, на которой располагались электроны, пошедшие на образование связи с электрофилом, можно выделить:
По атому, образующему связь
Углеродные нуклеофилы
Нуклеофилами с реакционным центром на атоме углерода являются:
Азотные нуклеофилы
Примерами азотных нуклеофилов являются аммиак (NH3), органические амины (RNH2, R2NH, R3N) и азиды (R−N3).
Кислородные нуклеофилы
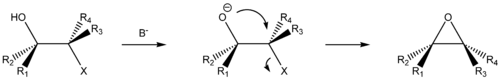
Типичными кислородными нуклеофилами являются вода (H2O), гидроксид-ион (OH − ), спирты (ROH) и алкоксиды (RO − ). В показанной ниже разновидности реакции Вильямсона сильное основание депротонирует спирт с образованием алкоксида. Атом кислорода затем внутримолекулярно замещает уходящую группу, приводя к образованию эпоксида − трёхчленного гетероцикла с одним атомом кислорода:
Серные нуклеофилы
Серосодержащие соединения обычно являются хорошими нуклеофилами, так как атом серы легко поляризуется, что облегчает передачу электронной пары. Типичные нуклеофилы этого класса — тиолы (RSH) и тиоляты (RS − ).
Шкалы нуклеофильности
Известно несколько способов количественного описания реакционной способности нуклеофилов. Приведенные ниже методы основаны на изучении экспериментальных данных о скорости определенных реакций с участием большого количества нуклеофилов и электрофилов. Как правило, реагенты с выраженным альфа-эффектом не включаются в эти корреляции.
Уравнение Свена-Скотта
Уравнение Свена-Скотта было выведено в 1953 году и является первой попыткой количественно описать реакционную способность нуклеофилов в реакциях SN2 [5] [6] :
В этом уравнении k — константа скорости реакции стандартного субстрата с данным нуклеофилом, k0 — константа скорости реакции субстрата со стандартным нуклеофилом (водой), S — параметр чувствительности субстрата к изменению нуклеофила (для CH3Br или CH3I S принимается равным 1), n — параметр нуклеофильности (для воды n = 0, табл. 1, 2).
Таким образом, для реакций
уравнение Свена-Скотта можно записать как
| Нуклеофил | Значение n | Нуклеофил | Значение n | Нуклеофил | Значение n |
|---|---|---|---|---|---|
| SO3 2− | 5,16 | CN − | 5,10 | I − | 5,04 |
| SCN − | 4,77 | HO − | 4,20 | N3 − | 4,00 |
| Br − | 3,89 | HCO3 − | 3,80 | Cl − | 3,04 |
| CH3COO − | 2,72 | SO4 2− | 2,50 | F − | 2,00 |
| NO3 − | 1,03 | CH3OH | 0,70 | H2O | 0,00 |
| Нуклеофил | Значение n | Нуклеофил | Значение n | Нуклеофил | Значение n |
|---|---|---|---|---|---|
| F − | 2,7 | Cl − | 4,37 | Br − | 5,79 |
| I − | 7,42 | N3 − | 5,78 | NC − | 6,70 |
| CH3OH | H2O | 0,00 | CH3CO2 − | 4,3 | |
| PhO − | 5,75 | CH3O − | 6,29 | Пиридин | 5,23 |
| Анилин | 5,70 | Триэтиламин | 6,66 | PhSH | 5,7 |
Уравнение Ричи
Уравнение Ричи было выведено в 1972 году [9] и выражается следующим образом [10] :

где 


| Нуклеофил (растворитель) | Значение N + | Нуклеофил (растворитель) | Значение N + |
|---|---|---|---|
| H2O (H2O) | 0,0 | MeOH (MeOH) | 0,5 |
| CN − (H2O) | 3,8 | CN − (MeOH) | 5,9 |
| HO − (H2O) | 4,5 | MeO − (MeOH) | 7,5 |
| N3 − (H2O) | 5,4 | N3 − (MeOH) | 8,5 |
| PhS − (ДМСО) | 13,1 | PhS − (MeOH) | 10,7 |
Уравнение Майра-Патца
В 1994 г. Г. Майр и М. Патц, на основании исследования реакционной способности диарилметильных катионов и других соединений, предложили уравнение, описывающее реакционную способность достаточно большого количества нуклеофилов и электрофилов [14] :
В этом уравнении константа скорости реакции второго порядка k, измеренная при 20 °C, связывается с параметром электрофильности E (для бис(п-метоксифенил)метильного катиона E = 0), параметром нуклеофильности N и фактором чувствительности s (для реакций 2-метил-1-пентена s = 1). Для реакций незаряженных нуклеофилов константа скорости слабо зависит от растворителя и последний обычно не указывается.
| Нуклеофил | N (s) | Нуклеофил | N (s) |
|---|---|---|---|
| 1 | −4,47 (1,32) | 2 | −0,41 (1,12) |
| 3 | +0,96 (1) | 4 | −0,13 (1,21) |
| 5 | +3,61 (1,11) | 6 | +7,48 (0,89) |
| 7 | +13,36 (0,81) | PhC − (CN)CH3 [16] | 28,95 (0,58) |
Параметр элекрофильности E для некоторых карбокатионов можно грубо оценить по следующему уравнению [14] :

где kw — константа псевдопервого порядка для реакции карбокатиона с водой при 20 °C.
Нуклеофильность N в уравнении Майра-Патца связана с параметром Ричи N+ следующим соотношением:
Объединенное уравнение
В попытке объединить все вышеописанные уравнения Майр с сотрудниками предложили следующее выражение [17] :

где sE — параметр чувствительности электрофила; sN — параметр чувствительности электрофила; N и E имеют такое же значение, как и в уравнении Майра-Патца.
С помощью соответствующих подстановок данное выражение можно превратить в любое описанное ранее уравнение:
См. также
Примечания
Полезное
Смотреть что такое «Нуклеофил» в других словарях:
нуклеофил — nukleofilas statusas T sritis chemija apibrėžtis Dalelė, turinti laisvą elektronų porą ar didesnį elektronų tankį. atitikmenys: angl. nucleophile rus. нуклеофил … Chemijos terminų aiškinamasis žodynas
Значение параметра нуклеофильности n для некоторых реагентов (вода, 25°С) — Нуклеофил Х: n S2O32 6,38 SO32 5,16 CN 5,10 … Химический справочник
Реакции нуклеофильного замещения — (англ. nucleophilic substitution reaction) реакции замещения, в которых атаку осуществляет нуклеофил реагент, несущий неподеленную электронную пару.[1] Уходящая группа в реакциях нуклеофильного замещения называется нуклеофуг. Все … Википедия
ТЕЛЕ-ЗАМЕЩЕНИЕ — замещение (обычно нуклеоф.) в аро матич. или гетероароматич. ряду, при к ром входящая группа вступает в положение, находящееся через один или более атомов от уходящей группы; обозначается … Химическая энциклопедия
НИТРОСОЕДИНEНИЯ — (С нитросоединения), содержат в молекуле одну или неск. нитрогрупп, непосредственно связанных с атомом углерода. Известны также N и О нитро соединения (см. Нитрамины и Нитраты органические). Нитрогруппа имеет строение, промежуточное между двумя… … Химическая энциклопедия
НУКЛЕОФИЛЬНЫЕ РЕАКЦИИ — гетеролитич. р ции орг. соед. с нуклеоф. реагентами (нуклеофилами, от лат. nucleus ядро и греч. phileo люблю). К н у к л е о ф и л а м относят анионы и молекулы (орг. и неорг.), к рые при участии в р ции отдают свою пару электронов на образование … Химическая энциклопедия
Аммиак — Общие Химическая формул … Википедия
Реакции присоединения — (англ. addition reaction) в органической химии так называются химические реакции, в которых одни химические соединения присоединяются к кратным (двойным или тройным) связям другого химического соединения. Присоединение может… … Википедия
БЕНЗОПИРИЛИЯ СОЛИ — (соли хромилия), содержат в молекуле катион бензопирилия структуры I или II. Хим. св ва этих структур различны вследствие фенольного характера кислорода в I и кетонного во II Соед. I не обменивает атом кислорода на др. гетеро атомы и не превращ.… … Химическая энциклопедия
ВАГНЕРА-МЕЕРВЕЙНА ПЕРЕГРУППИРОВКИ — общее назв. р ций, протекающих с 1,2 миграцией группы R(H, алкил или алициклич. фрагмент, арил, ацил, алкоксикарбонил и др.) к карбкатионному центру, возникающему в молекуле при нуклеоф. замещении, присоединении к кратной связи или элиминировании … Химическая энциклопедия