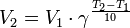Что называется температурным коэффициентом скорости реакции
Зависимость скорости реакции от температуры. Правило Вант-Гоффа, особенности температурного коэффициента для биохимических процессов. Уравнение Аррениуса. Энергия активации
Уравнение, которое описывает это правило, следующее:
где 

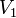
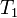

отношению константы скорости при температуре Т + 10 к константе при температуре Т.
Для большинства биохимических реакций температурный коэффициент Вант-Гоффа варьирует от 1,5 ¸ 3,0. Поэтому, если в результате какого-либо заболевания температура человеческого тела поднялась, например, с 36,50 до 39,50С, это значит увеличение скорости происходящих биохимических процессов в 1,13 – 1,39 раз, т.е. на 13-39%.
Объяснение зависимости скорости реакции от температуры было дано С.Аррениусом. К реакции приводит не каждое столкновение молекул реагентов, а только наиболее сильные столкновения. Лишь молекулы, обладающие избытком кинетической энергии, способны к химической реакции. С.Аррениус рассчитал долю активных (т.е. приводящих к реакции) соударений реагирующих частиц α, зависящую от температуры:
и вывел уравнение Аррениуса для константы скорости реакции:
Поясним на примере реакции в общем виде:
По оси ординат откладываем потенциальную энергию системы, а по оси абсцисс – ход реакции:
Чтобы войти в химический контакт друг с другом, реагирующие вещества А2 и В2 должны преодолеть энергетический барьер. На это затрачивается энергия активации. В случае применения катализатора значение энергии активации Еа меньше, чем без использования катализатора Еа /
Дата добавления: 2018-02-28 ; просмотров: 4096 ; Мы поможем в написании вашей работы!
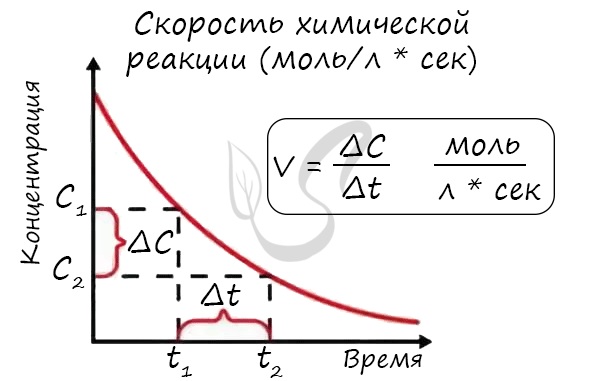
Скорость химической реакции
Скорость реакции отражает изменение концентраций реагирующих веществ за единицу времени. Единицы измерения для гомогенной реакции: моль/л * сек. Физический смысл в том, что каждую секунду какое-то количество одного вещества превращается в другое в единице объема.
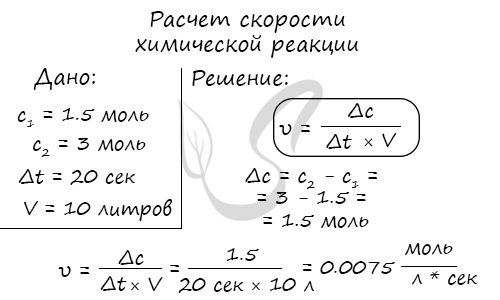
Мне встречались задачи, где была дана молярная концентрация вещества до реакции и после, время и объем. Требовалось посчитать скорость реакции. Давайте решим подобное несложное задание для примера:
Влияние природы реагирующих веществ
При изучении агрегатных состояний веществ возникает вопрос: где же быстрее всего идут реакции: между газами, растворами или твердыми веществами?
Запомните, что самая высокая скорость реакции между растворами, в жидкостях. В газах она несколько ниже.
Если реакция гетерогенная: жидкость + твердое вещество, газ + твердое вещество, жидкость + газ, то большую роль играет площадь соприкосновения реагирующих веществ.
Химическая активность также играет важную роль. Например, отвечая на вопрос: какой из металлов Li или K быстрее прореагирует с водой? Мы отдадим предпочтение литию, так как в ряду активности металлов он стоит левее калия, а значит литий активнее калия.
Иногда для верного ответа на вопрос о скорости реакции требуется знание активности кислот. Мы подробнее обсудим эту тему в гидролизе, однако сейчас я замечу: чем сильнее (активнее) кислота, тем быстрее идет реакция.
Например, реакцию магния с серной кислотой протекает гораздо быстрее реакции магния с уксусной кислотой. Причиной этому служит то, что серная кислота относится к сильным (активным) кислотам, а активность уксусной кислоты меньше, она является слабой кислотой.
Как я уже упомянул, слабые и сильные кислоты и основания изучаются в теме гидролиз.
Влияние изменения концентрации
Замечу деталь, которая может оказаться важной, если в реакции участвуют газы: при увеличении давления концентрация вещества на единицу объема возрастает (представьте, как газ сжимается). Поэтому увеличение давление, если среди исходных веществ есть газ, увеличивает скорость реакции.
Закон действующих масс устанавливает соотношение между концентрациями реагирующих веществ и их продуктами. Скорость простой реакции aA + bB → cC определяют по уравнению:
Записанное выше следствие закона действующих масс нужно не только «зазубрить», но и понять. Поэтому мы решим пару задач, где потребуется написать подобную формулу.
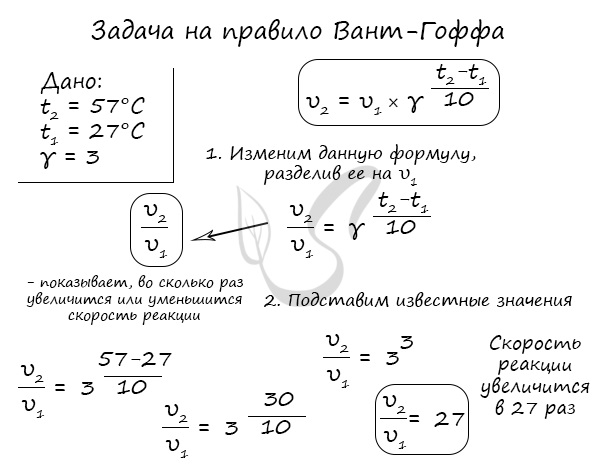
Окисление диоксида серы протекает по уравнению: 2SO2(г) + O2 = 2SO3(г). Как изменится скорость этой реакции, если объемы системы уменьшить в три раза?
По итогу решения становится ясно, что скорость реакции в таком случае возрастет в 27 раз.
Решим еще одну задачу. Дана реакция синтеза аммиака: N2 + ЗН2 = 2NH3. Как изменится скорость прямой реакции образования аммиака, если уменьшить концентрацию водорода в два раза?
В результате решения мы видим, что при уменьшении концентрации водорода в два раза скорость реакции замедлится в 8 раз.
Влияние изменения температуры на скорость реакции
Постулат, который рекомендую временно взять на вооружение: «Увеличение температуры увеличивает скорость абсолютно любой химической реакции: как экзотермической, так и эндотермической. Исключений нет!»
Правило Вант-Гоффа, голландского химика, позволяет точно оценить влияние температуры на скорость химической реакции. Оно звучит так: «При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза»
Если по итогам решения задач у вас получится температурный коэффициент меньше 2 или больше 4, то, скорее всего, где-то вы допустили ошибку. Используйте этот факт для самопроверки.
Для тренировки решим пару задач, в которых потребуется использование правило Вант-Гоффа.
Как изменится скорость гомогенной реакции при повышении температуры от 27°C до 57°C при температурном коэффициенте, равном трем?
Иногда в задачах требуется рассчитать температурный коэффициент, как, например, здесь: «Рассчитайте, чему равен температурный коэффициент скорости, если известно, что при понижении температуры от 250°C до 220°C скорость реакции уменьшилась в 8 раз».
Катализаторы и ингибиторы
Ингибиторы применяют для замедления коррозии металла, окисления топлива, старения полимеров. Многие лекарственные вещества являются ингибиторами.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Скорость химической реакции
Что называется температурным коэффициентом скорости реакции? Какие значения он может принимать?
Температурный коэффициент скорости реакции показывает, во сколько раз увеличивается скорость реакции при увеличении температуры на каждые 10 градусов.
Для обычных химических реакций= 2-4
Для ферментативных реакций= 7-9
Именно поэтому колебания температуры тела человека на 1 градус сказывается на самочувствии.
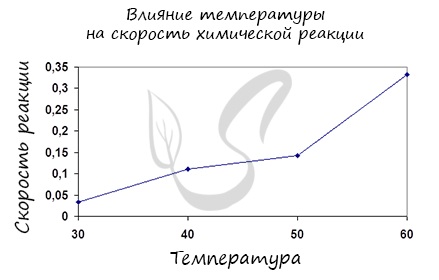
Влияние температуры на скорость биологических процессов.
При повышении или уменьшении температуры скорость химических реакций существенно изменяется. С точки зрения закона действующих масс это изменение скорости обусловлено температурной зависимостью константы скорости. В интервале 273-320 К температурная зависимость имеет нормальный характер. С увеличением температуры скорость возрастает, с уменьшение – падает.
Сущность теории активации Аррениуса. Способы активации молекул. Понятие об энергии активации.
Теория активации столкновений: не каждое столкновение приводит к акту химического взаимодействия; к химическому взаимодействию приводят только те столкновения, в которых участвуют частицы обладающие энергией необходимой для данного взаимодействия (энергия активации); при соударении частицы должны быть определённым образом ориентированы относительно друг друга.
Энергия активации— минимальная энергия взаимодействия частиц достаточная для того, чтобы все частицы вступили в химическую реакцию ( кДж/моль). Характеризует энергетический барьер, преодоление которого реагирующими частицами приводит к образованию конечных веществ. Зависит от природы реагирующих веществ и путей протекания химического процесса и не зависит от температуры.
Энергетический профиль химической реакции.
Чем определяется величина энергии активации конкретной реакции? Влияние величины энергии активации на скорость реакции.
За величину энергии активации приближенно принимают превышение средней энергии активированного комплекса над средним уровнем энергии исходных веществ. Она зависит от природы реагирующих (исходных) веществ и характеризует изменение скорости реакции от температуры. Чем больше энергия активации, тем быстрее увеличивается с ростом температуры скорость реакции.
Высокая энергия активации делает практически невозможным многие реакции которые с точки зрения ТД могли бы происходить.
Связь энергии активации с константой скорости реакции. Уравнение Аррениуса.
Чем больше энергия активации, тем меньше будет константа и скорость реакции, т.к. в системе будет меньше число активных частиц. При повышении температуры реакции за счет увеличения энергии системы резко возрастает число активных частиц и этим объясняется значение повышения скорости реакции.
K=A*e Ea / RT – уравнение Аррениуса
К- константа скорости реакции при температуре Т
А- предэкспоненциальный коэффициент учитывающий частоту столкновений частиц ориентированных определенным образом
е-основание натурального логарифма
Еа- энергия активации
R- универсальная газовая постоянная
Экспериментальное определение энергии активации.
А)Экспериментальное определение энергии активации химических реакций основано на измерении температурной зависимости скорости. Затем из измерений скорости реакции при различных температурах рассчитывают значения константы скорости реакции при различных температурах и далее с помощью уравнения Аррениуса находят величину энергии активации
Б)Энергию активации можно найти по экспериментальным данным несколькими способами. Согласно одному из них, исследуют кинетику реакции при нескольких температурах (о методах см. в ст. Скорость химической реакции) и строят график в координатах In k — 1/T; тангенс угла наклона прямой на этом графике, в соответствии с уравнением Аррениуса, равен Е. Для одностадийных обратимых реакций (см. Обратимые и необратимые реакции) энергию активации реакции в одном из направлений (прямом или обратном) можно вычислить, если известна энергия активации реакции в другом и температурная зависимость константы равновесия (из термодинамических данных). Для более точных расчетов следует учитывать зависимость энергии активации от температуры.
Дата добавления: 2020-04-25 ; просмотров: 1057 ; Мы поможем в написании вашей работы!
Правило Вант-Гоффа. Температурный коэффициент скорости реакции
Зависимость скорости реакции от температуры приближенно определяется эмпирическим правилом Вант-Гоффа: при изменении температуры на каждые 10 градусов скорость большинства реакций изменяется в 2-4 раза.
Математически правило Вант-Гоффа выражается так:

где v(T2) и v(T1) — скорости реакций, соответственно при температурах Т2 и T1 (T2> T1);
γ-температурный коэффициент скорости реакции.
Значение γ для эндотермической реакции выше, чем для экзотермической. Для многих реакций γ лежит в пределах 2-4.
Физический смысл величины γ заключается в том, что он показывает, во сколько раз изменяется скорость реакции при изменении температуры на каждые 10 градусов.
Поскольку скорость реакции и константа скорости химической реакции прямопропорциональны, то выражение (3.6) часто записывают в следующем виде:

где k(T2), k(T1)- константы скорости реакции соответственно
при температурах T2 и T1;
Пример 8. На сколько градусов надо повысить температуру, что бы скорость реакции возросла в 27 раз? Температурный коэффициент реакции равен 3.
Решение. Используем выражение (3.6):

Получаем: 27 = 

Ответ: на 30 градусов.
Скорость реакции и время, за которое она протекает, связаны обратно пропорциональной зависимостью: чем больше v, тем
меньше t. Математически это выражается соотношением

Пример 9. При температуре 293 К реакция протекает за 2 мин. За какое время будет протекать эта реакция при температуре 273 К, если γ = 2.
Решение. Из уравнения (3.8) следует:

Используем уравнение (3.6), поскольку 

Правило Вант-Гоффа применимо для ограниченного числа химических реакций. Влияние температуры на скорость процес-сов чаще определяют по уравнению Аррениуса.
Уравнение Аррениуса. В 1889 г. шведский ученый С. Арре-1иус на основании экспериментов вывел уравнение, которое на-звано его именем

где k — константа скорости реакции;
k0 — предэксноненциальный множитель;
е — основание натурального логарифма;
Ea — постоянная, называемая энергией активации, определяемая природой реагентов:
R-универсальная газовая постоянная, равная 8,314 Дж/моль×К.
Значения Еa для химических реакций лежат в пределах 4 — 400 кДж/моль.
Многие реакции характеризуются определенным энергети-ческим барьером. Для его преодоления необходима энергия актации — некоторая избыточная энергия (по сравнению со вредней энергией молекул при данной температуре), которой должны обладать молекулы для того, чтобы их столкновение было эффективным, т. е. привело бы к образованию нового ве-щества. С ростом температуры число активных молекул быстро увеличивается, что и приводит к резкому возрастанию скорости реакции.
В общем случае, если температура реакции изменяется от Т1 до Т2, уравнение (3.9) после логарифмирования примет вид:

Это уравнение позволяет рассчитывать энергию активации реакции при изменении температуры от Т1 до Т2.
Скорость химических реакций возрастает в присутствии катализатора. Действие катализатора заключается в том, что он образует с реагентами неустойчивые промежуточные соединения (активированные комплексы), распад которых приводит к. образованию продуктов реакции. При этом энергия активации, понижается, и активными становятся молекулы, энергия которых была недостаточна для осуществления реакции в отсутствие, катализатора. В результате возрастает общее число активных£ молекул и увеличивается скорость реакции.
Изменение скорости реакции в присутствии катализатора выражается следующим уравнением:

где vкат, и Ea(кат) — скорость и энергия активации химической реакции в присутствии катализатора;
v и Еа — скорость и энергия активации химической реакции без катализатора.
Пример 10. Энергия активации некоторой реакции в отсутствие катализатора равна 75,24 кДж/моль, с катализатором — 50,14 кДж/моль. Во сколько раз возрастает скорость реакции в присутствии катализатора, если реакция протекает при температуре 298 К? Решение. Воспользуемся уравнением (3.11). Подставляя в уравнение данные
Еа = 75,24 кДж / моль = 75,24 ×103 Дж / моль и
Еа(кат)=- 50,14 кД/моль= 50,14 ×103 Дж /моль, получим
Окончательно находим:
Таким образом, снижение энергии активации на 25,1 кДж/моль привело к увеличению скорости реакции в 25 000 раз.
Большая Энциклопедия Нефти и Газа
При помощи температурного коэффициента скорости реакции Kt была подсчитана брутто-энергия активации суммарной реакции окисления метана. [32]
Существенно, что температурный коэффициент скорости реакции и связанный с этим уровень значений энергии активации соответствуют обычно наблюдаемым при исследовании реакции уретанообразования с участием неблокированных диизоцианатов. [34]
Считая, что температурный коэффициент скорости реакции равен трем, вычислить, на сколько градусов надо повысить температуру, чтобы скорость реакции возросла в 10, 50 и 100 раз. [35]
Поэтому при указании температурного коэффициента скорости реакции необходимо учитывать, для каких именно температур он берется. [36]
Для подавляющего большинства реакций температурный коэффициент скорости реакции больше 1, причем величина его может изменяться в широких пределах. [39]
При некоторых экзотермических реакциях с большим температурным коэффициентом скорости реакции в случае превы-шфия определенной температуры скорость тепловыделения ста-норится больше максимальной возможности теплоотвода реактора; тогда в нем быстро возрастает температура, что может привести к аварии. В подобных случаях особенно высокие требования предъявляются к точности САР температуры, а безопасность проведения технологического процесса обеспечивается применением системы автоматической блокировки реактора по температуре. [42]
Из этого равенства следует, что температурный коэффициент скорости реакции определяется ее энергией активации. Так как энергии активации реакций органических соединений, вообще говоря, весьма различны ( от 10 до 75 ккал), то и температурные коэффициенты сильно меняются. Поэтому с изменением температуры, при которой производится сравнение, могут полностью измениться соотношения скоростей реакций всех соединений. Следовательно, мы должны указывать не только реагент, с которым производится сравнение скоростей реакций галюидосоединений, но и температуру, при которой производится сравнение. [43]
Из этого равенства следует, что температурный коэффициент скорости реакции определяется ее энергией активации. Так как энергии активации реакций органических соединений, вообще говоря, весьма различны ( от 10 до 75 / скал), то и температурные коэффициенты сильно меняются. Поэтому с изменением температуры, при которой производится сравнение, могут полностью измениться соотношения скоростей реакций всех соединений. Следовательно, мы должны указывать не только реагент, с которым производится сравнение скоростей реакции галшдоеоедннений, но и температуру, при которой производится сравнение. [44]
Этот же характер зависимости подтверждает величину температурного коэффициента скорости реакции ( стр. [45]