Что называется скоростью химической реакции
Скорость химической реакции
Скорость химической реакции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства. Является ключевым понятием химической кинетики. Скорость химической реакции — величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение умножается на −1.
Например для реакции:
выражение для скорости будет выглядеть так:

В 1865 году Н. Н. Бекетовым и в 1867 году Гульдбергом и Вааге был сформулирован закон действующих масс:
Скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведенным степени, равные их стехиометрическим коэффициентам.
Для элементарных реакций показатель степени при значении концентрации каждого вещества часто равен его стехиометрическому коэффициенту, для сложных реакций это правило не соблюдается. Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы:
Если мы рассмотрим самую простую химическую реакцию A + B → C, то мы заметим, что мгновенная скорость химической реакции величина непостоянная.
Литература
Полезное
Смотреть что такое «Скорость химической реакции» в других словарях:
СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ — основное понятие химической кинетики. Для простых гомогенных реакций скорость химической реакции измеряют по изменению числа молей прореагировавшего вещества (при постоянном объеме системы) или по изменению концентрации любого из исходных веществ … Большой Энциклопедический словарь
СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ — основное понятие хим. кинетики, выражающее отношение количества прореагировавшего вещества (в молях) к отрезку времени, за которое произошло взаимодействие. Поскольку при взаимодействии изменяются концентрации реагирующих веществ, скорость обычно … Большая политехническая энциклопедия
скорость химической реакции — [reaction rate] величина, характеризизующая интенсивность химической реакции. Скоростью образования продукта реакции называют количество этого продукта в результате реакции за единицу времени в единице объема (если реакция гомогенна) или на… … Энциклопедический словарь по металлургии
скорость химической реакции — основное понятие химической кинетики. Для простых гомогенных реакций скорость химической реакции измеряют по изменению числа молей прореагировавшего вещества (при постоянном объёме системы) или по изменению концентрации любого из исходных веществ … Энциклопедический словарь
Скорость химической реакции — величина, характеризующая интенсивность реакции химической (См. Реакции химические). Скоростью образования продукта реакции называется количество этого продукта, возникающее в результате реакции за единицу времени в единице объёма (если… … Большая советская энциклопедия
СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ — осн. понятие хим. кинетики. Для простых гомогенных реакций С. х. р. измеряют по изменению числа молей прореагировавшего в ва (при пост. объёме системы) или по изменению концентрации любого из исходных в в или продуктов реакции (если объём системы … Естествознание. Энциклопедический словарь
МЕХАНИЗМ ХИМИЧЕСКОЙ РЕАКЦИИ — Для сложных реакций, состоящих из неск. стадий (простых, или элементарных реакций), механизм это совокупность стадий, в результате к рых исходные в ва превращаются в продукты. Промежуточными в вами в этих реакциях могут выступать как молекулы,… … Естествознание. Энциклопедический словарь
Реакции нуклеофильного замещения — (англ. nucleophilic substitution reaction) реакции замещения, в которых атаку осуществляет нуклеофил реагент, несущий неподеленную электронную пару.[1] Уходящая группа в реакциях нуклеофильного замещения называется нуклеофуг. Все … Википедия
Реакции химические — превращения одних веществ в другие, отличные от исходных по химическому составу или строению. Общее число атомов каждого данного элемента, а также сами химические элементы, составляющие вещества, остаются в Р. х. неизмененными; этим Р. х … Большая советская энциклопедия
скорость волочения — [drawing speed] линейная скорость движения металла на выходе из волоки, м/с. На современных волочильных машинах скорость волочения достигает 50 80 м/с. Однако даже при волочении проволоки скорость, как правило, не превышает 30 40 м/с. При… … Энциклопедический словарь по металлургии
Скорость химической реакции
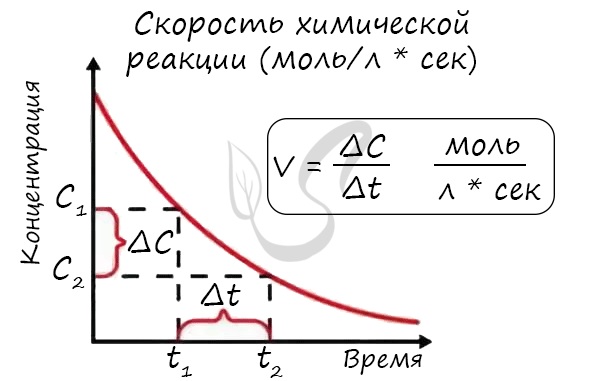
Скорость реакции отражает изменение концентраций реагирующих веществ за единицу времени. Единицы измерения для гомогенной реакции: моль/л * сек. Физический смысл в том, что каждую секунду какое-то количество одного вещества превращается в другое в единице объема.
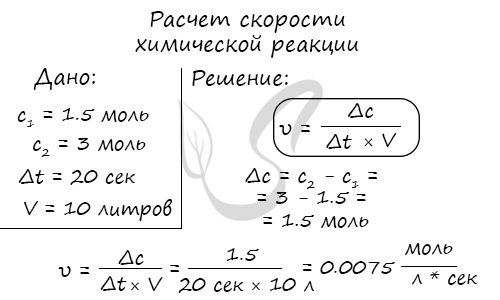
Мне встречались задачи, где была дана молярная концентрация вещества до реакции и после, время и объем. Требовалось посчитать скорость реакции. Давайте решим подобное несложное задание для примера:
Влияние природы реагирующих веществ
При изучении агрегатных состояний веществ возникает вопрос: где же быстрее всего идут реакции: между газами, растворами или твердыми веществами?
Запомните, что самая высокая скорость реакции между растворами, в жидкостях. В газах она несколько ниже.
Если реакция гетерогенная: жидкость + твердое вещество, газ + твердое вещество, жидкость + газ, то большую роль играет площадь соприкосновения реагирующих веществ.
Химическая активность также играет важную роль. Например, отвечая на вопрос: какой из металлов Li или K быстрее прореагирует с водой? Мы отдадим предпочтение литию, так как в ряду активности металлов он стоит левее калия, а значит литий активнее калия.
Иногда для верного ответа на вопрос о скорости реакции требуется знание активности кислот. Мы подробнее обсудим эту тему в гидролизе, однако сейчас я замечу: чем сильнее (активнее) кислота, тем быстрее идет реакция.
Например, реакцию магния с серной кислотой протекает гораздо быстрее реакции магния с уксусной кислотой. Причиной этому служит то, что серная кислота относится к сильным (активным) кислотам, а активность уксусной кислоты меньше, она является слабой кислотой.
Как я уже упомянул, слабые и сильные кислоты и основания изучаются в теме гидролиз.
Влияние изменения концентрации
Замечу деталь, которая может оказаться важной, если в реакции участвуют газы: при увеличении давления концентрация вещества на единицу объема возрастает (представьте, как газ сжимается). Поэтому увеличение давление, если среди исходных веществ есть газ, увеличивает скорость реакции.
Закон действующих масс устанавливает соотношение между концентрациями реагирующих веществ и их продуктами. Скорость простой реакции aA + bB → cC определяют по уравнению:
Записанное выше следствие закона действующих масс нужно не только «зазубрить», но и понять. Поэтому мы решим пару задач, где потребуется написать подобную формулу.
Окисление диоксида серы протекает по уравнению: 2SO2(г) + O2 = 2SO3(г). Как изменится скорость этой реакции, если объемы системы уменьшить в три раза?
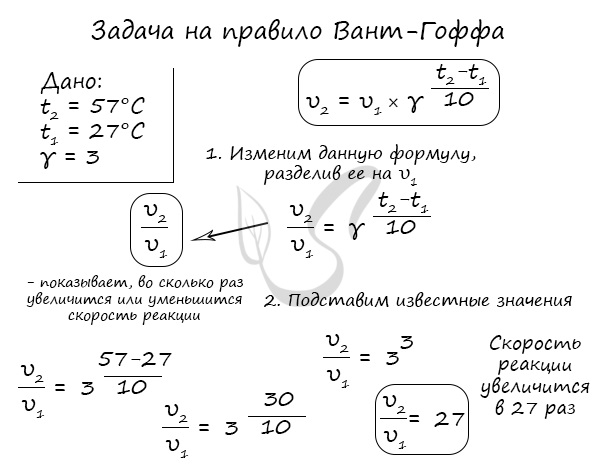
По итогу решения становится ясно, что скорость реакции в таком случае возрастет в 27 раз.
Решим еще одну задачу. Дана реакция синтеза аммиака: N2 + ЗН2 = 2NH3. Как изменится скорость прямой реакции образования аммиака, если уменьшить концентрацию водорода в два раза?
В результате решения мы видим, что при уменьшении концентрации водорода в два раза скорость реакции замедлится в 8 раз.
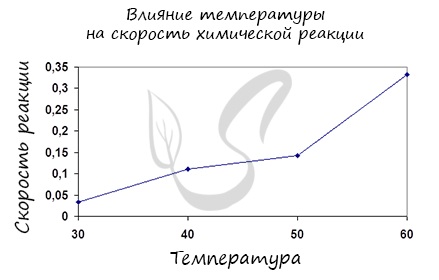
Влияние изменения температуры на скорость реакции
Постулат, который рекомендую временно взять на вооружение: «Увеличение температуры увеличивает скорость абсолютно любой химической реакции: как экзотермической, так и эндотермической. Исключений нет!»
Правило Вант-Гоффа, голландского химика, позволяет точно оценить влияние температуры на скорость химической реакции. Оно звучит так: «При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза»
Если по итогам решения задач у вас получится температурный коэффициент меньше 2 или больше 4, то, скорее всего, где-то вы допустили ошибку. Используйте этот факт для самопроверки.
Для тренировки решим пару задач, в которых потребуется использование правило Вант-Гоффа.
Как изменится скорость гомогенной реакции при повышении температуры от 27°C до 57°C при температурном коэффициенте, равном трем?
Иногда в задачах требуется рассчитать температурный коэффициент, как, например, здесь: «Рассчитайте, чему равен температурный коэффициент скорости, если известно, что при понижении температуры от 250°C до 220°C скорость реакции уменьшилась в 8 раз».
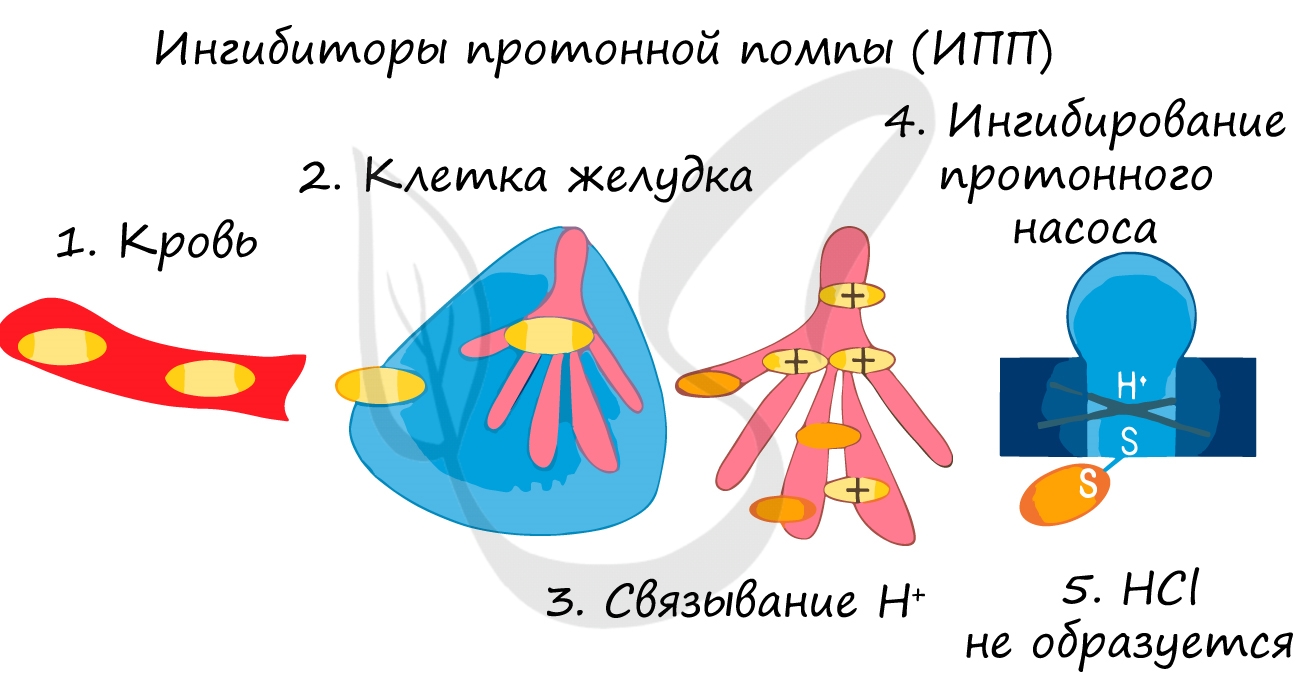
Катализаторы и ингибиторы
Ингибиторы применяют для замедления коррозии металла, окисления топлива, старения полимеров. Многие лекарственные вещества являются ингибиторами.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Скорость химической реакции
Скорость химической реакции, ее зависимость от различных факторов
Содержание:
Скорость химической реакции — изменение количества одного из реагирующих веществ в единицу времени. Скорость химической реакции занимает разный промежуток времени при определенных условиях. Например, в водных растворах они проходят быстрее, чем на твердых поверхностях. Самые быстрые процессы случаются во время взрыва смесей газов. Понятие скорости реакции описывает изменение количества реагента и продукта реакции за промежуток времени. В зависимости от условий протекания реакции разделяют гомогенные и гетерогенные процессы.
Гомогенные и гетерогенные химические реакции
Гомогенные реакции протекают в однородно среде: газообразной или водной. Взаимодействие реагентов происходит не точечно, а во всем объеме. Скорость для такой реакции рассчитывают по формуле:
Δn : ΔtV = Vгомогенная,
Отношение химического количества вещества к объему, выражают как концентрацию ∆с. Следовательно, формула приобретает упрощенный вид:
Δc : Δt = vгомогенная
Такая формула подходит для реакций, где все вещества находятся в одинаковом агрегатном состоянии, например: газы, жидкости.
Гетерогенные реакции характеризуются процессами, происходящими на поверхности соприкосновения двух веществ, находящихся в разных агрегатных состояниях. Например, между газом и жидкостью, газом и твердым веществом, жидкостью и твердым веществом, двух несмешивающихся жидкостей. Для такого процесса характерна формула:
Δc : ΔtS = моль : с*м 2 = v гетерогенной, где
Расчет по формуле имеет погрешности. Для процессов соблюдают определенные условия протекания: температуру, концентрацию, площадь, катализатор. При их изменении происходит влияние на скорость химической реакции.
Температура
Повышение температуры ускоряет химический процесс. Это изменение описывает правилом Вант-Гоффа, оно говорит:
Внутри пробирки молекулы из-за увеличения температуры не увеличивают подвижность. Но начинают постоянно ударятся друг о друга, за счет чего процесс проходит быстрее. Это правило описывают формулой:
Это правило не всегда работает, так как некоторые вещества способны испарятся при увеличении температуры, а также полностью разлагаться или расщепляется.
Экзотермические и эндотермические реакции
Экзотермические реакции сопровождаются выделением большого количества тепла. Процесс легко и быстро проходят. Все окислительно-восстановительные реакции выделяют много тепла. Оно представляет собой энергию и записывается как +Q.
Эндотермические, наоборот, требуют получения большого количества энергии от внешних факторов. Чтобы такие реакции протекали, реагенты долго нагревают. Они протекают медленно и долго, имеют обозначение в виде –Q.
Концентрация реагирующих веществ
При увеличении концентрации исходных реагентов увеличивается столкновение молекул, благодаря чему скорость химической реакции увеличивается. Этот правило описывает закон действующих масс:
Правило выражается в виде формулы: k1СH х Сj У =v, где
Этот закон не учитывает концентрации реагентов, находящих в твердом состоянии, так как их показатели постоянные. Реакция протекает на отведенной поверхности, где концентрация не меняется.
Действие катализатора
Катализаторы – это вещества, которые способствуют увеличению скорости химической реакции, прокладывают правильный путь к концу процесса. Использование катализаторов называется катализом. Выделяют два вида:
Эти вещества используются в промышленности, бывают разной природы: ферменты, газы, твердые вещества, ингибиторы.
Природа реагирующих веществ
Природа реагентов зависит от энергии активации – минимальный запас энергии, который сохраняет молекула, чтобы произошло соприкосновение с другой молекулой.
Значение влияет на скорость химической реакции:
Скорость активации с промежуточными значениями характеризуется средней скоростью реакции. Половина частиц активно сталкивается, а вторая половина находится в спокойном состоянии.
Поверхность соприкосновения реагирующих веществ
Чем больше площадь исходного реагента, тем меньше скорость химической реакции. Например, вещества в виде порошка растворяются быстрее, чем твердые. Это также зависит от состояния кристаллической решетки, состояния ионов.
Влияние на скорость химической реакции
Факторы
Результат
Природа реагентов
Чем активнее исходное вещество, тем скорее протекает реакция
Концентрация исходных веществ
При увеличении концентрации исходных реагентов, реакция ускорятся
Площадь соприкосновения
Чем больше площадь соприкосновения, тем выше скорость
Температура
На каждые 10°С скорость увеличивается в 2-4 раза
Скорость химической реакции
Говорить об осуществимости процесса можно по изменению энергии Гибсса системы. Но данная величина не отражает настоящую возможность протекания, механизм и скорость химической реакции.
Понятие скорости химической реакции
Для полноценного представления химической реакции, надо иметь знания о том, какие существуют временные закономерности при ее осуществлении, т.е. скорость химической реакции и ее детальный механизм.
Определение скорости химической реакции:
Скорость химической реакции — это изменение концентрации реагирующих веществ в единицу времени
Скорость и механизм реакции изучает химическая кинетика – наука о химическом процессе.
С точки зрения химической кинетики, реакции можно классифицировать на простые и сложные.
Простые реакции – процессы, протекающие без образования промежуточных соединений. По количеству частиц, принимающих в ней участие, они делятся на мономолекулярные, бимолекулярные, тримолекулярные. Соударение большего чем 3 числа частиц маловероятно, поэтому тримолекулярные реакции достаточно редки, а четырехмолекулярные — неизвестны.
Сложные реакции – процессы, состоящие из нескольких элементарных реакций.
Любой процесс протекает с присущей ему скоростью, которую можно определить по изменениям, происходящим за некий отрезок времени.
Среднюю скорость химической реакции выражают изменением количества вещества n израсходованного или полученного вещества в единице объема V за единицу времени t.
Если вещество расходуется, то ставим знак «-», если накапливается – «+»
При постоянном объеме:
Единица измерения скорости реакции — моль/л·с
В целом, υ — величина постоянная и не зависит от того, за каким участвующим в реакции веществом, мы следим.
Зависимость концентрации реагента или продукта от времени протекания реакции представляют в виде кинетической кривой, которая имеет вид:
Вычислять υ из экспериментальных данных удобнее, если указанные выше выражения преобразовать в следующее выражение:
| υ = — ΔC/Δt [моль/л·с] | |
Закон действующих масс. Порядок и константа скорости реакции
Одна из формулировок закона действующих масс звучит следующим образом:
Скорость элементарной гомогенной химической реакции прямо пропорциональна произведению концентраций реагентов.
Т.е. скорость прямой химической реакции зависит от концентраций исходных веществ.
Если исследуемый процесс представить в виде:
а А + b В = продукты
то скорость химической реакции можно выразить кинетическим уравнением:
а и b – стехиометрические коэффициенты простой реакции,
k – константа скорости реакции.
Химический смысл величины константы скорости реакции k — это скорость реакции при единичных концентрациях.
То есть, если концентрации веществ А и В равны 1, то υ = k.
Надо учитывать, что в сложных химических процессах коэффициенты а и b не совпадают со стехиометрическими.
Закон действующих масс выполняется при соблюдении ряда условий:
К сложным процессам закон действия масс применить нельзя!
Это можно объяснить тем, что сложный процесс состоит из нескольких элементарных стадий, и его скорость будет определяться не суммарной скоростью всех стадий, лишь одной самой медленной стадией, которая называется лимитирующей.
Каждая реакция имеет свой порядок. Определяют частный (парциальный) порядок по реагенту и общий (полный) порядок.
Например, в выражении скорости химической реакции для процесса
а А + b В = продукты
a – порядок по реагенту А
Для простых процессов порядок реакции указывает на количество реагирующих частиц (совпадает со стехиометрическими коэффициентами) и принимает целочисленные значения.
Для сложных процессов порядок реакции не совпадает со стехиометрическими коэффициентами и может быть любым.
Факторы, влияющие на скорость химической реакции
Определим факторы, влияющие на скорость химической реакции υ:
1. Зависимость скорости реакции от концентрации реагирующих веществ
определяется законом действующих масс:
Очевидно, что с увеличением концентраций реагирующих веществ, скорость реакции υ увеличивается, т.к. увеличивается число соударений между участвующими в химическом процессе веществами.
Причем, важно учитывать порядок реакции:
если это n = 1 по некоторому реагенту, то ее скорость прямо пропорциональна концентрации этого вещества.
Если по какому-либо реагенту n = 2, то удвоение его концентрации приведет к росту скорости реакции в 2 2 = 4 раза.
А увеличение концентрации в 3 раза ускорит реакцию в 3 2 = 9 раз.
2. Зависимость скорости реакции от давления
Таким образом, изменение концентрации в системе, а следовательно и скорости реакции имеет прямую зависимость от изменения давления.
Например, для реакции первого порядка, увеличение давления в 2 раза вызовет рост концентрации вещества в 2 раза, что непременно изменит скорость реакции υ – она станет в 2 раза больше.
3. Зависимость скорости реакции от площади поверхности
Для гетерогенных реакций скорость реакции зависит от площади соприкосновения частиц:
Δn — изменение количества веществ, принимающих участие в реакции (исходных веществ или продуктов реакции), моль;
Δt — промежуток времени, с;
Единица измерения скорости гетерогенной реакции, моль/м 2 ⋅с.
Таким образом, вещества реагируют быстрее, если площадь поверхности, на которой может происходить взаимодействие веществ больше.
Растворяя вещество, мы уменьшаем его размеры до размеров молекулы, увеличивая тем самым площадь поверхности.
Поэтому химические процессы между веществами, находящимися в растворенном, жидком или газообразном состоянии имеют большую скорость, чем взаимодействия между твердыми веществами.
В этом случае, большое значение имеет строение электронной оболочки атома, тип химической связи и ее прочность в молекулах, структура вещества, прочность его кристаллической решетки.
Например, натрий будет активнее взаимодействовать с водой, чем олово. Поэтому и скорость взаимодействия натрия с водой выше скорости взаимодействия олова с водой.
5. Зависимость скорости реакции от температуры
определяется правилом Вант-Гоффа и уравнением Аррениуса
Повышая температуру, мы сообщаем молекулам дополнительную энергию (увеличивая, тем самым, энергию активации), которая способствует протеканию реакции.
Поэтому, при повышении температуры скорость химической реакции увеличивается.
Сванте Аррениус в 1889 году, изучая зависимость скорости реакции υ от температуры, установил, что большинство химических процессов подчиняются уравнению:
где k — константа скорости реакции
Еа -энергия активации – минимальная (критическая) энергия, необходимая для осуществления реакции, единица измерения Дж/моль
Т — абсолютная температура
R – газовая постоянная, R = 8,314 Дж/моль·град
A — предэкспоненциальный множитель (частотный фактор), единица измерения совпадает с k. Эта константа выражает вероятность того, что при столкновении молекулы будут ориентированы так, чтобы взаимодействие было возможно.
Если известна константа скорости k при одной температуре Т1, а требуется найти константу скорости k при некой другой температуре Т2, то это легко сделать, если взять логарифм уравнения Аррениуса при Т1 и Т2:
Вычитая второе равенство из первого, получаем:
Если принять, что концентрации веществ А и В постоянны и прологарифмировать данное выражение, то получим следующее выражение:
Правило Вант-Гоффа
Также удобно пользоваться эмпирическим правилом, которое сформулировал Якоб Вант-Гофф:
увеличение температуры на каждые 10 градусов, приводит к росту скорости реакции в 2 – 4 раза.
Правило Вант-Гоффа имеет математическое выражение:
γ — температурный коэффициент реакции, значения которого лежат в интервале от 2 до 4.
Приведем пример применения правила Вант-Гоффа.
υT1/υT2 = 3 2 = 9. Это означает, что υ возросла в 9 раз.
6. Зависимость скорости реакции от присутствия катализатора
Катализ – это любое изменение скорости реакции под действием катализатора. Он может быть положительным и отрицательным. Суть катализа – генерирование активного субстрата или реагента с участием катализаторов.
Катализатор представляет собой вещество, которое селективно ускоряет химическую реакцию, вступая при этом в промежуточную стадию, но регенирируясь к ее концу (к моменту образования конечных продуктов). Например, в биохимической среде в качестве катализаторов выступают ферменты.
Если такое вещество замедляет химическую реакцию, то оно называется ингибитором.
Влияние катализатора на скорость реакции основывается на том, что он изменяет энергию активации Еа. Понижение энергии активации под действием катализатора схематично представлено на рисунке ниже:
Видно, что веществам А и В требуется большое количество энергии, чтобы образовать конечные продукты. Но в присутствии катализатора для получения конечных продуктов требуется гораздо меньше энергии, т.к. идет понижение полной энергии активации, и тем самым, увеличение скорости реакции.
Обращаю ваше внимание на то, что энергии как начальных, так и конечных веществ остаются одинаковыми в обеих реакциях.