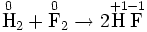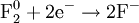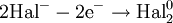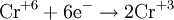Что называется окислением и как заменяется степень окисления окислителя
Электроотрицательность. Степень окисления и валентность химических элементов. Реакции окислительно — восстановительные.
Окислительно-восстановительные реакции
Одним из основных понятий неорганической химии является понятие о степени окисления (СО).
Степенью окисления элемента в соединении называется формальный заряд атома элемента, вычисленный из предположения, что валентные электроны переходят к атомам с большей относительной электроотрицательностью (ОЭО) и все связи в молекуле соединения являются ионными.
Применяют также метод Штока обозначения степени окисления римскими цифрами после символа элемента: Mn (VII), Fe (III).
Вопрос о знаке степени окисления атомов в молекуле решается на основании сопоставления электроотрицательностей связанных между собой атомов, которые образуют молекулу. При этом атом с меньшей электроотрицательностью имеет положительную степень окисления, а с большей электроотрицательностью отрицательную.
Следует отметить, что нельзя отождествлять степень окисления с валентностью элемента. Валентность, определяемая как число химических связей, которыми данный атом соединен с другими атомами, не может равняться нулю и не имеет знака « + » или « ». Степень окисления может иметь как положительное, так и отрицательное значение, а также принимать нулевое и даже дробное значение. Так, в молекуле СO2 степень окисления С равна +4, а в молекуле СН4 степень окисления С равна 4. Валентность же углерода и в том, и в другом соединении равна IV.
Несмотря на указанные выше недостатки, использование понятия степени окисления удобно при классификации химических соединений и составлении уравнений окислительно-восстановительных реакций.
При окислительно-восстановительных реакциях протекают два взаимосвязанных процесса: окисление и восстановление.
Окислением называется процесс потери электронов. Восстановлением процесс присоединения электронов.
Вещества, атомы или ионы которых отдают электроны, называются восстановителями. Вещества, атомы или ионы которых присоединяют электроны (или оттягивают к себе общую пару электронов), называются окислителями.
При окислении элемента степень окисления увеличивается, иначе говоря, восстановитель при реакции повышает степень окисления.
Наоборот, при восстановлении элемента степень окисления понижается, т. е. при реакции окислитель уменьшает степень окисления.
Таким образом, можно дать и такую формулировку окислительно-восстановительных реакций: окислительно-восстановительными реакциями называются реакции, протекающие с изменением степени окисления атомов элементов, входящих в состав реагирующих веществ.
Окислители и восстановители
К типичным восстановителям относятся простые вещества, атомы которых имеют малую ОЭО Опубликовано admin в 17:01
Что называется окислением и как заменяется степень окисления окислителя
Репетитор по химии и биологии
Первый МГМУ им. И.М. Сеченова
выпускник репетитора В.Богуновой
РНИМУ им. Н.И. Пирогова
выпускник репетитора В.Богуновой
Первый МГМУ им. И.М. Сеченова
выпускница репетитора В.Богуновой
МГМСУ, лечебный факультет
выпускница репетитора В.Богуновой
РНИМУ им. Н.И. Пирогова
выпускница репетитора В.Богуновой
Первый МГМУ им. И.М. Сеченова
выпускница репетитора В.Богуновой
Первый МГМУ им. И.М. Сеченова
выпускница репетитора В. Богуновой
Первый МГМУ им. И.М. Сеченова
выпускница репетитора В. Богуновой
· Кислородные соединения галогенов
· ОВР с органическими восстановителями
· Комбинированные задачи с ОВР
Окислительную активность определяют два фактора:
2) Степень окисления. Чем выше степень окисления атома в составе молекулы или иона, тем ярче проявляется окислительная активность.
Только свойства окислителя проявляют атомы с максимально возможной степенью окисления (она равна номеру группы).
Восстановительную активность определяют два фактора:
1) Радиус атома. Чем больше радиус атома химического элемента, тем выше восстановительная активность простого вещества. В Периодической Системе Элементов радиус атома увеличивается в сторону левого нижнего угла (справа налево и сверху вниз).
2) Степень окисления. Чем ниже степень окисления атома в составе молекулы или иона, тем ярче проявляется восстановительная активность. Сера в роли восстановителя в разных веществах (с разными степенями окисления):
Окисление
Окисли́тельно-восстанови́тельные реа́кции — это химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
Содержание
Описание
В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого.
Окисление
При окисле́нии вещества в результате отдачи электронов увеличивается его степень окисления. Атомы окисляемого вещества, называются донорами электронов, а атомы окислителя — акцепторами электронов.
В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части. При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле.
Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель:
окислитель + e − ↔ сопряжённый восстановитель.
Восстановление
Восстановле́нием называется процесс присоединения электронов атомом вещества, при этом его степень окисления понижается.
При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента. Примеры: восстановление оксидов металлов до свободных металлов при помощи водорода, углерода, других веществ; восстановление органических кислот в альдегиды и спирты; гидрогенизация жиров и др.
Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель:
Виды окислительно-восстановительных реакций
Примеры
Окислительно-востановительная реакция между водородом и фтором
Разделяется на две полуреакции:Ы
Окисление, восстановление
В окислительно-восстановительных реакциях электроны от одних атомов, молекул или ионов переходят к другим. Процесс отдачи электронов — окисление. При окислении степень окисления повышается:
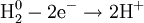

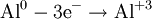
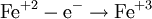
Процесс присоединения электронов — восстановление. При восстановлении степень окисления понижается:
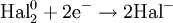
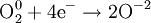

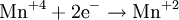
Атомы или ионы, которые в данной реакции присоединяют электроны являются окислителями, а которые отдают электроны — восстановителями.
Мнемонические правила
Для запоминания процессов окисления-восстановления, а также свойств окислителей и восстановителей существует несколько мнемонических правил:
См. также
Ссылки
Полезное
Смотреть что такое «Окисление» в других словарях:
Окисление — Окисление. В области научной терминологии широко и наглядно сказалась огромная словообразующая роль словарного фонда. Из слов, принадлежащих к основному словарному фонду и выражающих очень конкретные бытовые значения, создавались новые… … История слов
ОКИСЛЕНИЕ — ОКИСЛЕНИЕ, химическая реакция присоединения кислорода или отнятия водорода. Для ионных процессов общепринята более расширенная формулировка: О. есть увеличение положительной валентности (заряда> или уменьшение отрицательной валентности… … Большая медицинская энциклопедия
окисление — – окисление масла – в работающем двигателе горячее масло постоянно циркулирует и контактирует с воздухом, продуктами полного и неполного сгорания топлива. Кислород воздуха ускоряет окисление масла. EdwART. Словарь автомобильного жаргона, 2009 … Автомобильный словарь
ОКИСЛЕНИЕ — ОКИСЛЕНИЕ, химическая реакция, включающая потерю атомом или молекулой одного или более ЭЛЕКТРОНОВ (всегда является частью реакции ОКИСЛЕНИЯ ВОССТАНОВЛЕНИЯ, при которой эти электроны приобретаются другим атомом или молекулой). Раньше этот термин… … Научно-технический энциклопедический словарь
окисление — оксидировка, оксидация, окисание, оксидирование, фотолиз Словарь русских синонимов. окисление сущ., кол во синонимов: 9 • автоокисление (2) • … Словарь синонимов
ОКИСЛЕНИЕ — в химии см. Окислительно восстановительные реакции … Большой Энциклопедический словарь
ОКИСЛЕНИЕ — ОКИСЛЕНИЕ, окисления, мн. нет, ср. (хим.). Химический процесс, при котором происходит соединение какого нибудь тела с кислородом. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
ОКИСЛЕНИЕ — ОКИСЛЕНИЕ, я, ср. (спец.). Химическая реакция соединения вещества с кислородом или с другим веществом, способным принимать электроны. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
окисление — Ндп. пережог рубашка Дефект в виде окисленного слоя металла с поверхности отливки, получившийся после отжига отливок из белого чугуна на ковкий чугун. [ГОСТ 19200 80] Недопустимые, нерекомендуемые пережогрубашка Тематики отливки из чугуна и стали … Справочник технического переводчика
окисление — Одна из разновидностей химического выветривания, особенно в горных породах, содержащих железо, в результате которого скальная поверхность приобретает коричневатый или желтоватый цвет и соответственно разрушается … Словарь по географии
окисление — – 1. Процесс взаимодействия с кислородом. 2. Процесс передачи электронов восстановителем в ходе окислительно восстановительной реакции. Словарь по аналитической химии [3] … Химические термины
Урок №67-68. Окислительно-восстановительные реакции
ОКИСЛИТЕЛЬ-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ (ОВР)
ОВР – это реакции, в ходе которых атомы изменяют свои степени окисления.
Основные положения теории ОВ реакций
1. Окислением называется процесс отдачи электронов атомом, молекулой или ионом.
При окислении степень окисления повышается.
2. Восстановлением называется процесс присоединения электронов атомом, молекулой или ионом.
При восстановлении степень окисления понижается.
F +9 ) 2 ) 7
F 0 + 1ē → F -1 в осстанавливается (окислитель)
В зял – В осстановился – Понизил СО
Na +11 ) 2 ) 8 ) 1
Na 0 – 1ē → Na +1 о кисляется (восстановитель)
О тдал – О кислился – Повысил СО
Задания для закрепления
№3. Расставьте коэффициенты в УХР методом электронного баланса, укажите процессы окисления (восстановления), окислитель (восстановитель); запишите реакции в полном и ионном виде:
А) Zn + HCl = H 2 + ZnCl 2
Б) Fe + CuSO 4 = FeSO 4 + Cu
№4. Даны схемы уравнений реакций:
СuS + HNO 3 (разб.) = Cu(NO 3 ) 2 + S + NO + H 2 O
K + H 2 O = KOH + H 2
Расставьте коэффициенты в реакциях используя метод электронного баланса.
№5. Расставьте коэффициенты в ОВР методом электронного баланса, укажите окислитель и восстановитель
MnO 2 + HCl = MnCl 2 + Cl 2 + H 2 O
H 2 S + KMnO 4 + H 2 SO 4 =S + MnSO 4 + K 2 SO 4 + H 2 O
Степень окисления химических элементов. Окислитель и восстановитель Окислительно-восстановительные реак-ции
Характерные химические свойства простых веществ — металлов: щелочных, щелочноземельных, алюминия, переходных металлов — меди, цинка, хрома, железа
С развитием производства металлов (простых веществ) и сплавов связано возникновение цивилизации (бронзовый век, железный век).
И, конечно же, мы не должны забывать, что в большинстве сплавов используют давно известный металл железо, а основу многих легких сплавов составляют сравнительно «молодые» металлы — алюминий и магний.
Сверхновыми стали композиционные материалы, представляющие, например, полимер или керамику, которые внутри (как бетон железными прутьями) упрочнены металлическими волокнами из вольфрама, молибдена, стали и других металлов и сплавов — все зависит от поставленной цели и необходимых для ее достижения свойств материала.
Такую химическую связь называют металлической. Металлическую связь образуют элементы, атомы которых на внешнем слое имеют мало валентных электронов по сравнению с большим числом внешних энергетически близких орбиталей. Их валентные электроны слабо удерживаются в атоме. Электроны, осуществляющие связь, обобществлены и перемещаются по всей кристаллической решетке в целом нейтрального металла.
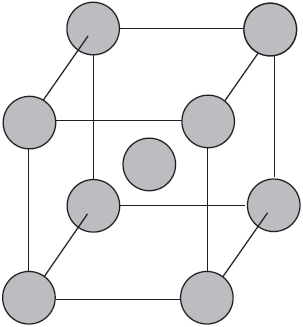
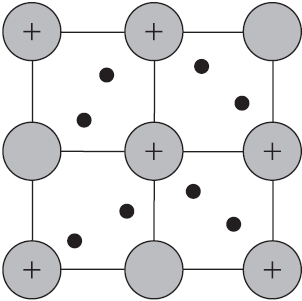
Веществам с металлической связью присущи металлические кристаллические решетки, которые обычно изображают схематически так, как показано на рисунке. Катионы и атомы металлов, расположенные в узлах кристаллической решетки, обеспечивают ее стабильность и прочность (обобществленные электроны изображены в виде черных маленьких шариков).
Металлическая связь — это связь в металлах и сплавах между атомионами металлов, расположенными в узлах кристаллической решетки, осуществляемая обобществленными валентными электронами.
Некоторые металлы кристаллизуются в двух или более кристаллических формах. Это свойство веществ — существовать в нескольких кристаллических модификациях — называют полиморфизмом.
Например, железо имеет четыре кристаллических модификации, каждая из которых устойчива в определенном температурном интервале:
Олово имеет две кристаллические модификации:
Конечно, особый вид химической связи и тип кристаллической решетки металлов должны определять и объяснять их физические свойства.
Каковы же они? Это металлический блеск, пластичность, высокая электрическая проводимость и теплопроводность, рост электрического сопротивления при повышении температуры, а также такие значимые свойства, как плотность, высокие температуры плавления и кипения, твердость, магнитные свойства.
Давайте попробуем объяснить причины, определяющие основные физические свойства металлов.
Почему металлы пластичны?
Механическое воздействие на кристалл с металлической кристаллической решеткой вызывает смещение слоев ион-атомов друг относительно друга, а так как электроны перемещаются по всему кристаллу, разрыв связей не происходит, поэтому для металлов характерна большая пластичность.
Аналогичное воздействие на твердое вещество с ковалентными связями (атомной кристаллической решеткой) приводит к разрыву ковалентных связей. Разрыв связей в ионной решетке приводит к взаимному отталкиванию одноименно заряженных ионов. По этому вещества с атомными и ионными кристаллическими решетками хрупкие.
Почему металлы имеют характерный блеск, а также непрозрачны?
Электроны, заполняющие межатомное пространство, отражают световые лучи (а не пропускают, как стекло), причем большинство металлов в равной степени рассеивают все лучи видимой части спектра. Поэтому они имеют серебристо-белый или серый цвет. Стронций, золото и медь в большей степени поглощают короткие волны (близкие к фиолетовому цвету) и отражают длинные волны светового спектра, поэтому имеют светло-желтый, желтый и медный цвета.
Хотя на практике металл не всегда нам кажется светлым телом. Во-первых, его поверхность может окисляться и терять блеск. Поэтому самородная медь выглядит зеленоватым камнем. А во-вторых, и чистый металл может не блестеть. Очень тонкие листы серебра и золота имеют совершенно неожиданный вид — они имеют голубовато-зеленый цвет. А мелкие порошки металлов кажутся темно-серыми, даже черными.
Наибольшую отражательную способность имеют серебро, алюминий, палладий. Их используют при изготовлении зеркал, в том числе и в прожекторах.
Почему металлы имеют высокую электрическую проводимость и теплопроводны?
Хаотически движущиеся электроны в металле под воздействием приложенного электрического напряжения приобретают направленное движение, т. е. проводят электрический ток. При повышении температуры металла возрастают амплитуды колебаний находящихся в узлах кристаллической решетки атомов и ионов. Это затрудняет перемещение электронов, электрическая проводимость металла падает. При низких температурах колебательное движение, наоборот, сильно уменьшается и электрическая проводимость металлов резко возрастает. Вблизи абсолютного нуля сопротивление у металлов практически отсутствует, у большинства металлов появляется сверхпроводимость.
Следует отметить, что неметаллы, обладающие электрической проводимостью (например, графит), при низких температурах, наоборот, не проводят электрический ток из-за отсутствия свободных электронов. И только с повышением температуры и разрушением некоторых ковалентных связей их электрическая проводимость начинает возрастать.
Наибольшую электрическую проводимость имеют серебро, медь, а также золото, алюминий, наименьшую — марганец, свинец, ртуть.
Чаще всего с той же закономерностью, как и электрическая проводимость, изменяется теплопроводность металлов.
Она обусловлена большой подвижностью свободных электронов, которые, сталкиваясь с колеблющимися ионами и атомами, обмениваются с ними энергией. Происходит выравнивание температуры по всему куску металла.
Механическая прочность, плотность, температура плавления у металлов очень сильно отличаются. Причем с увеличением числа электронов, связывающих ион-атомы, и уменьшением межатомного расстояния в кристаллах показатели этих свойств возрастают.
Кальций, имеющий два электрона на внешнем энергетическом уровне атомов, гораздо более тверд и плавится при более высокой температуре ($842°С$).
Еще более прочной является кристаллическая решетка, образованная ионами скандия, который имеет три валентных электрона.
Металлы по-разному взаимодействуют с магнитным полем. Такие металлы, как железо, кобальт, никель и гадолиний выделяются своей способностью сильно намагничиваться. Их называют ферромагнетиками. Большинство металлов (щелочные и щелочноземельные металлы и значительная часть переходных металлов) слабо намагничиваются и не сохраняют это состояние вне магнитного поля — это парамагнетики. Металлы, выталкиваемые магнитным полем, — диамагнетики (медь, серебро, золото, висмут).
В технике принято классифицировать металлы по различным физическим свойствам:














_1.jpg)
_6.jpg)
_2.jpg)
_3.jpg)
_5.jpg)