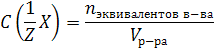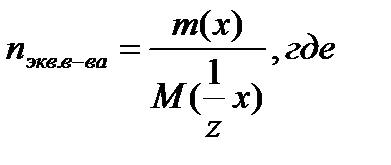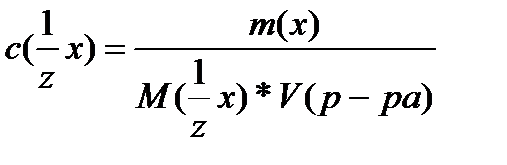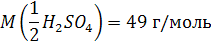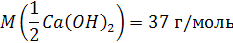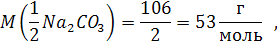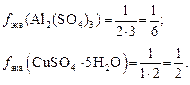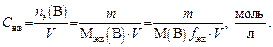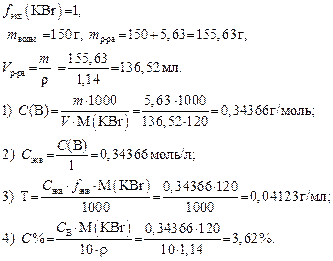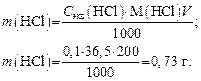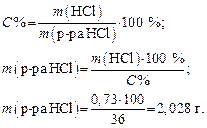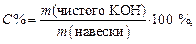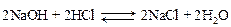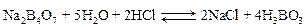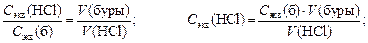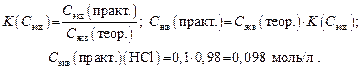Что называется молярной концентрацией эквивалента
Молярная концентрация эквивалента (нормальная концентрация)
Молярная концентрация эквивалента C(1/Z Х) (или н-нормальность) – это число молей эквивалентов растворенного вещества, содержащееся в 1 л раствора:
m(x) – масса растворенного вещества, г;
M(1/z x) – молярная масса эквивалента вещества, г/моль;
n экв. в-ва – количество вещества эквивалентов, моль.
Молярную концентрацию эквивалента вещества можно рассчитать по формуле:
Раствор называется однонормальным или нормальным, если в 1 л его содержится 1 моль эквивалентов растворенного вещества.
При определении количества вещества, необходимого для приготовления раствора той или иной нормальности, необходимо знать правила определения эквивалентов.
Молярная массам эквивалента кислоты равна ее молярной массе, деленной на основнойсть кислоты.
Так для соляной кислоты масса эквивалента равна ее молярной массе. Для двухосновной серной кислоты масса эквивалента равна 49 г (98 : 2)
Молярная масса эквивалента основания равна его молярной массе, деленной на кислотность основания (валентность металла или число гидроксидных групп).
Например, молярная масса эквивалента гидроксида калия равна его молярной массе, а масса эквивалента гидроксида кальция Ca(OH)2 будет равна 74:2 = 37 г.
Для солей масса эквивалента равна молярной массе соли, деленной на произведение степени окисления металла и числа его атомов в молекуле соли.
Так масса эквивалента карбоната натрия равна 106 : (1 * 2) = 53 г.
а масса эквивалента Al2(SO4)3 равна 342 : 6(3 * 2) = 57 г/моль
Способы выражения концентрации
Существует множество способов измерить концентрацию раствора. Это так называемые способы выражения концентрации раствора.
Концентрация раствора — это количество вещества, находящегося в единице объема или массы раствора.
Что такое раствор
Среди окружающих нас веществ, лишь немногие представляют собой чистые вещества. Большинство являются смесями, состоящими из нескольких компонентов, которые могут находиться в одном или различных фазовых состояниях.
Смеси, имеющие однородный состав являются гомогенными, неоднородный состав – гетерогенными.
Иначе, гомогенные смеси, называют растворами, в которых одно вещество полностью растворяется в другом (растворителе). Растворитель – это тот компонент раствора, который при образовании раствора сохраняет свое фазовое состояние. Он обычно находится в наибольшем количестве.
Существуют растворы газовые, жидкие и твердые. Но более всего распространены жидкие растворы, поэтому, в данном разделе, именно на них мы сосредоточим свое внимание.
Концентрацию раствора можно охарактеризовать как:
Качественная концентрация характеризуется такими понятиями, как разбавленный и концентрированный раствор.
С этой точки зрения растворы можно классифицировать на:
Количественная концентрация выражается через молярную, нормальную (молярную концентрацию эквивалента), процентную, моляльную концентрации, титр и мольную долю.
Способы выражения концентрации растворов
Молярная концентрация растворов (молярность)
Раствор называют молярным или одномолярным, если в 1 литре раствора растворено 1 моль вещества, децимолярным – растворено 0,1 моля вещества, сантимолярным — растворено 0,01 моля вещества, миллимолярным — растворено 0,001 моля вещества.
Термин «молярная концентрация» распространяется на любой вид частиц.
Вместо обозначения единицы измерения — моль/л, возможно такое ее обозначение – М, например, 0,2 М HCl.
Молярная концентрация эквивалента или нормальная концентрация растворов (нормальность).
Понятие эквивалентности мы уже вводили. Напомним, что эквивалент – это условная частица, которая равноценна по химическому действию одному иону водорода в кислотоно-основных реакциях или одному электрону в окислительно – восстановительных реакциях.
Например, эквивалент KMnO4 в окислительно – восстановительной реакции в кислой среде равен 1/5 (KMnO4).
Еще одно необходимое понятие — фактор эквивалентности – это число, обозначающее, какая доля условной частицы реагирует с 1 ионом водорода в данной кислотоно-основной реакции или с одним электроном в данной окислительно – восстановительной реакции.
Он может быть равен 1 или быть меньше 1. Фактор эквивалентности, например, для KMnO4 в окислительно – восстановительной реакции в кислой среде составляет fэкв(KMnO4) = 1/5.
Следующее понятие – молярная масса эквивалента вещества х. Это масса 1 моля эквивалента этого вещества, равная произведению фактора эквивалентности на молярную массу вещества х:
Молярная концентрация эквивалента (нормальность) определяется числом молярных масс эквивалентов на 1 литр раствора.
Для обозначения нормальной концентрации допускается сокращение «н» вместо «моль/л».
Процентная концентрация раствора или массовая доля
Массовая концентрация показывает сколько единиц массы растворенного вещества содержится в 100 единицах массы раствора.
Это отношение массы m(х) вещества x к общей массе m раствора или смеси веществ:
Массовую долю выражают в долях от единицы или процентах.
Моляльная концентрация раствора
Моляльная концентрация раствора b(x) показывает количество молей n растворенного вещества х в 1 кг. растворителя m. Единица измерения моляльной концентрации — моль/кг :
Титр раствора
Титр раствора показывает массу растворенного вещества х, содержащуюся в 1 мл. раствора. Единица измерения титра — г/мл:
Мольная или молярная доля
Мольная или молярная доля α(х) вещества х в растворе равна отношению количества данного вещества n(х) к общему количеству всех веществ, содержащихся в растворе Σn:
Между приведенными способами выражения концентраций существует взаимосвязь, которая позволяет, зная одну единицу измерения концентрации найти (пересчитать) ее в другие единицы. Существуют формулы, позволяющие провести такой пересчет, которые, в случае необходимости, вы сможете найти в сети. В разделе задач показано, как произвести такой пересчет, не зная формул.
Пример перевода процентной концентрации в молярную, нормальную концентрацию, моляльность, титр
Решение.
1. Рассчитать молярную массу FeSO4:
M (FeSO4) = 56+32+16·4 = 152 г/моль
2. Рассчитать молярную массу эквивалента:
Мэ = fэкв· М(FeSO4) = 1/2·152 = 76 г/моль
3. Найдем m раствора объемом 2 л
4. Найдем массу 2 % раствора по формуле:
m(FeSO4) = 0,02·2,06 = 0,0412 кг = 41,2 г
5. Найдем молярность, которая определяется как количество молей растворенного вещества в одном литре раствора:
n = m/М
n = 41,2/152 = 0,27 моль
См = n/V
См = 0,27/2 = 0,135 моль/л
6. Найдем нормальность:
nэ = 41,2/76 = 0,54 моль
Сн = 0,54/2 = 0,27 моль/л
7. Найдем моляльность раствора. Моляльная концентрация равна:
b (x) = n(x)/m
Масса растворителя, т.е. воды в растворе равна:
mH2O = 2,06-0,0412 = 2,02 кг
b (FeSO4) = n(FeSO4)/m = 0,27/2,02 = 0,13 моль/кг
8. Найдем титр раствора, который показывает какая масса вещества содержится в 1 мл раствора:
Т(х) = m (х)/V
Т(FeSO4) = m (FeSO4)/V = 41,2/2000 = 0,0021 г/мл
Молярная концентрация эквивалента



Эквивалент – есть 1/z часть частицы (молекулы, атома).
У окислителей и восстановителей Z будет равно числу принятых или отданных электронов. Например, для процесса: Mn +7 + 5e à Mn +2 Z * = 5. От молекулы КMnO4 только 1/5 часть будет эквивалентной одному электрону.
Обратная величина числу эквивалентов (Z) – это фактор эквивалентности – f. Он и показывает, какая часть от реальной частицы эквивалентна иону или атому водорода, или одному электрону (в ОВР).
Он принимает дробные значения: 1/2, 1/3, 1/4 и т.д.
Для оснований и амфотерных гидроксидов в форме оснований число эквивалентов Z равно числу гидроксид-анионов. Например, Z(KOH) = 1;
Z (Са(OH)2) = 2 (без учета протекания реакций или до средних или до основных солей)
Для кислот Z равно числу атомов водорода, то есть, основности кислоты. Например, Z (HCl) = 1. Z (H3PO4 ) = 3
У солей Z равно произведению валентности (степени окисления) металла на число атомов металла. Например, Z(CaCl2) = (+2) · 1 = 2; Z (Al2(SO4)3) = 3·2 = 6.
У окислителей и восстановителей Z будет равно числу принятых или отданных электронов.
Например:
и наоборот:
Рассмотрим значения Z и f для многоосновных кислот и многокислотных оснований не в процессе окислительно-восстановительных реакций, а в процессе протекания реакций обмена:
Таким образом, f (Н2SO4,) = ½ в данном уравнении. Заметим, что по рассуждениям соответствия NaOH и H OH f (NaOH) всегда будет равен 1 (как и KOH, HCl, LiOH, HNO3, т.е. однокислотных оснований и одноосновных кислот). В аналитической химии говорят, что растворы KOH, HCl, LiOH, HNO3, NaOH готовят с учетом реальных частиц (Z = 1 и f =1), т.е. 1 моль (или одной молекулы), а не какой – то части.
Рассмотрим другой случай:
Расчет фактора эквивалентности в уравнениях реакций через коэффициент стехиометричности смотри в приложении.
II. Величины более мелких частиц («дробленых»), выраженные как количество вещества называются количеством вещества эквивалента:
где: ν – обычное количество вещества Х
Z – число эквивалентов вещества Х
ν1/Z (Х) – количество вещества эквивалентов для вещества (Х)
Дано 6 моль серной кислоты: 6 H2SO4 (это обычное количество вещества.) При Z =2 и f = ½ в каждом моль кислоты содержится уже 2 дробленых частицы, т.е., количества вещества эквивалентных частиц = 2. В 6 моль эквивалентных будет 12, в 2 раза больше.
Вывод: количество вещества эквивалента всегда больше обычного количества вещества в Z раз.
III. Молярная масса эквивалента. (M1/z).
Из данных формул видно, что вместо обычной молярной массы в них входит величина M1/z – молярная масса эквивалента (дробленой части одного моль) и, конечно, она будет меньше молярной массы в Z раз:
M1/z = или M1/z = М · f à M = M1/z · Z или M = Z f
Например: Если Z (H2SO4 ) = 2 или f = ½; М= 98 г/моль
Или M1/z = М · f = 98 г/моль · ½ = 49 г/моль
Этот расчет можно оформить в виде задачи:
Задача 13: Рассчитать молярную массу эквивалента H2SO4:
Решение:
Задача 14: Рассчитать количество вещества эквивалента для 2-х моль KMnO4
Дано: Решение:
ν (KMnO4) = 2 моль ν 1/Z = Z ·ν = 5 ·2 моль = 10 моль (-экв)
в) Молярная масса эквивалента: M 1/Z = (г/моль, кг/ моль) Z * x
IV. Молярная концентрация эквивалента. (С1/z).
Вспомним формулы обычной молярной концентрации:
Вывод: для одной и той же массы вещества или объема вещества молярная концентрация эквивалента (эквивалентных частиц) больше, чем молярная концентрация в Z раз.
Математически: это частное от деления количества вещества, содержащегося в системе к объему системы.
Задача16: В растворе объемом 7 литров содержится KMnO4 31,6 г. Рассчитать молярную концентрацию раствора и молярную концентрацию эквивалента.
1) Находим молярную концентрацию р-ра
2) Находим молярную концентрацию эквивалента:
Задача 17: В растворе объемом 5 л содержится серная кислота массой 98 г, молярная масса 98 г/моль Вычислить молярную концентрацию и молярную концентрацию эквивалента.
1 способ:
m (H2SO4) = 98 г 1) С = 0,2 моль/л
M = 98 г\моль M V 98г/моль·5 л Z = 2
2) С1/Z = С · Z = 0,2 моль\л. 2 = 0,4 моль /л
М 98 г/моль M1/z = 49 г/моль
Тогда
С1/z 0,4 моль/л С = 0.2 моль/л
Задача18: Рассчитать массу карбоната натрия для приготовления раствора объемом 50 мл с молярной концентрацией эквивалента 0,15 моль/л.
Массу обычно рассчитывают до 4-го знака после запятой.
Задача 19: Какой объем хлороводородной кислоты с массовой долей 38 % и плотностью 1,19 г\мл надо взять для приготовления раствора объемом 500 мл и молярной концентрацией эквивалента 2 моль\л
Для решения задачи разберем условие и увидим, что речь идет о двух растворах. Берут раствор кислоты с процентной концентрацией (массовой долей), неизвестного в задаче объема и из этого раствора готовят раствор с молярной концентрацией эквивалента. В задаче не говорят, как готовят раствор: добавлением воды или выпариванием определенного количества воды. Да нас это и не должно волновать. Главное мы должны увидеть, что связкой между растворами является неизменная масса чистого вещества хлороводорода. Массу чистого вещества хлороводорода можно вычислить из данных того раствора, которых достаточно для подстановки в формулу.
Для записи условия необходимо правильно и четко поставить индексы 1 и 2 для каждого из двух растворов:
Дано: Решение
W, % (HCl)1 = 38 % 1) Найдем массу HCl чист., содержащегося в
V ( HCl) р-ра2 = 500 мл 500 мл раствора HCl c молярной конц.
С1\Z ( HCl) р-ра2 = 2 моль/л эквивалента 2 моль/л, так как для этого
М HCl = 36,5 г/моль есть все данные
2 ) Рассчитаем, какова масса 38 % 1р-ра HCl, если масса HСlчист = 36,5г
1) Найдем объем 38%-го раствора HCl c массой 96,05 г
Выводы и указания для решения такого типа задач:
1. Помните что в формуле с использованием молярной концентрации или молярной концентрации эквивалента подразумевается объем с использованием размерности – литр [л]
2. В формуле перевода массы раствора в объем раствора через плотность используется размерность г/мл и в результате объем получаем в миллилитрах [мл].
3. Порядок логических рассуждений и прием запоминания:
а) Неизвестное ищем для раствора с W (массовой долей), поэтому сначала работаем с концентрацией «С1/z»; (ищем массу чистого вещества)
б) Затем работаем с формулой, включающей W (ищем массу необходимого раствора)
в) Переводим массу раствора в плотность по формуле с использованием «треугольника»:
— буква «С» находится по алфавиту раньше, чем W – работаем с формулой
— буква «W» находится в алфавите после «С» и затем работаем с ней;
— работаем с «треугольником».
Всего выполняем 3 действия в такой задаче. Однако, если необходимо, то переводим М в М1/z
V. Закон эквивалентов
Вещества взаимодействуют между собой в эквивалентных количествах:
Как следствие закона эквивалентов: концентрации реагирующих веществ обратно пропорциональны их объемам.
Задача 20: Определите молярную концентрацию эквивалента серной кислоты, 16 мл которой вступило в реакцию нейтрализации с 50 мл гидроксида натрия, молярная концентрация эквивалента которого 0,2 моль/л.
Задача 21: Сколько мл раствора гидроксида калия с концентрацией 0,2 моль/л потребуется для нейтрализации 20 мл раствора серной кислоты с концентрацией 0,1 моль/л.
2. В задачах 20 и 21 не нужно размерность «мл» переводить в «л».
Если в задаче такого типа используется одноосновная кислота, например, азотная или соляная, то С1/z = С.
Титр.
Титр – это масса растворенного вещества, содержащегося в 1 мл раствора.
Размерность такая же, как у плотности.
Если указано, что титр кислоты HCl с молярной концентрацией эквивалента 0,1 моль/л равен 0,00365 г/мл, то это означает, что в 1 мл данного раствора содержится 0,00365 г HCl титр вычисляют до 4-х значащих цифр после нулей. Зная титр, можно вычислить массу вещества в любом объеме раствора:
Титр можно вычислять: Т = (формула 2)
Так как m = С·М·V, то, подставив это значение в формулу 1 получим:
И далее, чтобы перевести «л» в «мл» необходимо дробь разделить на 1000.
Для записи значения титра сохраняются 4 значащих цифры.
Примеры записи:
Т = 0, 012801 = 0,01280 (после всех нулей – 4 значащих цифры)
Молярная концентрация эквивалента(нормальная или эквивалентная концентрация)
Молярная концентрация эквивалента (нормальность) показывает, какое количество моль эквивалентов растворенного вещества содержится в 1 л раствора.
Молярную концентрацию эквивалента Сэк(В) находят как отношение количества эквивалентов вещества nэк(В) к объему раствора Vp
Размерность молярной концентрации эквивалента: моль•л. Сокращенная форма записи единицы молярной концентрации эквивалента – н. моль•л. Например, 2н. означает, что в 1 л раствора содержится 2 моль эквивалента растворенного вещества.
Зная массу растворенного вещества m(B) и его молярную массу эквивалента Мэк(В), можно найти количество эквивалента вещества:
Молярная масса эквивалента вещества равна произведению фактора эквивалентности fэк(В) на молярную массу вещества М(В)
Эквивалент – это реальная или условная частица вещества, соответствующая в реакциях обмена одному атому или иону водорода (Н или Н+), а в окислительно-восстановительных реакциях – одному электрону.
Фактор эквивалентности – число, показывающее, какую часть от реальной частицы (молекулы, атома, иона и т.д.) вещества составляет эквивалент этого вещества.

Например, для Na3PO4 заряд катиона Na+ равен 1, число катионов – 3, тогда
Пример. Вычислите молярную концентрацию эквивалента хлорида железа (III) в растворе, полученном при растворении 40 г FeCl3 в 200 мл воды. Плотность раствора 1,182 г/мл.
Молярная масса хлорида железа (III):
Фактор эквивалентности fэк = 1/3.
Молярная масса эквивалента
Mэк(FeCl3) = fэк(FeCl3)•M(FeCl3) = 162 • (1/3) = 54 г/моль.
Количество эквивалента вещества, содержащегося в 40 г хлорида железа (III), составляет:
r(H2O) = 1 г/мл; m(H2O) = 200 • 1 = 200 г;
mp = 40 + 200 = 240 г.
Объем раствора:
Находим молярную концентрацию эквивалента раствора хлорида железа (III):
Молярная концентрация эквивалента
Эквивалент – это реальная или условная частица, которая может присоединять или высвобождать один ион водорода в кислотно-основных реакциях или один электрон в окислительно-восстановительных реакциях. Единицей количества вещества эквивалента является моль – n экв(B).
Фактор эквивалентностиfэкв(В) – число, показывающее, какая доля реальной частицы вещества В эквивалентна одному иону H + в данной кислотно-основной реакции или одному электрону в окислительно-восстановительной реакции. Фактор эквивалентности – безразмерная величина, fэкв £ 1. Его рассчитывают из формулы кислоты, основания, соли, кристаллогидрата или по стехиометрии указанной реакции.

Например, fэкв(HCl) = 1, fэкв(H2SO4) = 1/2, fэкв(H3PO4) =1/3. Но если многоосновная кислота в конкретной реакции проявляет себя как одноосновная кислота или двухосновная, то fэкв ее будет меняться.
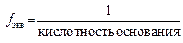
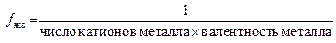
Молярная масса эквивалентов вещества Мэкв(В)– это масса моля эквивалентов вещества В. Она равна произведению фактора эквивалентности на молярную массу вещества В:
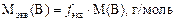
Например: Mэкв(H2SO4) = 98 г/моль ´ 1/2 = 49 г/моль.
Молярная концентрация эквивалента Сэкв(В)или упрощенно
Cэкв – это отношение количества вещества эквивалента nэкв(В) к объему раствора (V) в литрах, т.е. количество вещества эквивалента, находящееся в 1 литре раствора:
Если объем раствора измеряется в миллилитрах, то

Молярная концентрация и молярная концентрация эквивалента связаны между собой соотношением: CВ = Cэкв ´ fэкв(В).
Старое обозначение Cэкв – N (нормальность). Например, запись: 0,1N означает, что в 1 л раствора содержится 0,1 моль-эквивалентов растворенного вещества.
Моляльная концентрация раствора
Моляльная концентрация вещества В в растворе (символ СМ, единица измерения моль/кг) – это отношение числа молей растворенного компонента к массе растворителя, выраженному в килограммах, т.е. количество вещества, содержащееся в килограмме растворителя:

Титр раствора
Титр раствора вещества В(символ Т, единица г/мл) – это отношение массы вещества к объему раствора, т.е. это масса вещества в граммах, содержащаяся в 1 мл раствора:
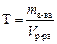
Все виды концентраций пропорциональны друг другу, следовательно, можно от одного способа выражения концентрации перейти к другому. Так, например:
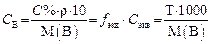
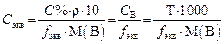

Обучающие задачи
Задача 1. Навеску 5,63 г KBr растворили в 150 г воды, плотность полученного раствора r = 1,14 г/мл. Рассчитайте СВ, Сэкв, Т и С% полученного раствора.
Задача 2. Определите навеску соли и массу воды, необходимые для приготовления 500 мл 0,85%-го раствора NaCl (r = 1,005 г/мл).
1. Находим массу раствора:
mр-ра = 1,005 г/мл × 500 мл = 502,5 г.
2. Определяем массу NaCl, необходимую для приготовления 502,5 г раствора:
3. Находим массу воды, необходимую для приготовления раствора:
Задача 3. Сколько миллилитров 36%-го HCl c r = 1,18 г/мл нужно взять, чтобы приготовить 200 мл раствора с Сэкв = 0,1 моль/л?
1. Определяем массу чистой HCl в 200 мл раствора:
2. Рассчитаем массу 36%-го раствора HCl, который содержит 0,73 г чистой HCl:
3. Определяем объем 36%-го раствора HCl:
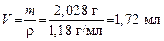
Отмеряем цилиндром 1,72 мл 36%-го раствора HCl, помещаем в мерную колбу на 200 мл и доливаем до метки водой, закрываем колбу и тщательно перемешиваем раствор. Получаем раствор HCl с концентрацией Сэкв = 0,1 моль/л.
Задача 4. Какой объем 35%-го раствора H2SO4 (r = 1,35 г/мл) нужно взять, чтобы приготовить 250 мл раствора с Т = 0,005 г/мл?
1. Определяем массу безводной H2SO4 в 500 мл раствора:
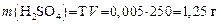
2. Рассчитываем объем 35%-го раствора, который содержит 1,25 г безводной H2SO4:

Задача 5. В техническом KОН содержание основного вещества составляет 92 %. Сколько граммов технического KОН надо взять для приготовления 250 мл раствора с концентрацией Сэкв = 0,1 моль/л?
1. Определяем молярную массу эквивалента KОН:
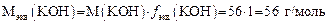
2. Определяем массу KОН в 250 мл раствора, который необходимо приготовить:
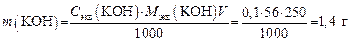
3. Расчитываем навеску технического KОН, содержащего 8 % примесей:
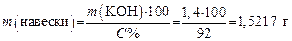
Помещают навеску 1,5217 г KOH в мерную колбу на 250 мл, растворяют, доливают водой до метки и перемешивают раствор. Получают раствор KOH с приблизительной концентрацией Cэкв = 0,1 моль/л.
Вопросы для самоконтроля
1. Основные понятия: раствор, растворенное вещество, растворитель, эквивалент, фактор эквивалентности.
2. Основные способы выражения концентраций растворов: массовая доля, молярная концентрация, молярная концентрация эквивалента, титр, моляльная концентрация раствора.
4.1.4. Домашнее задание № 4
Решите задачу приготовления раствора заданной концентрации.
Задание 1.Рассчитайте массу соли и объем воды, необходимые для получения 250 мл раствора с заданной молярной концентрацией (СB, моль/л) (см. свой вариант в табл. 9).
Задание 2.Рассчитайте массовую долю (в %), молярную концентрацию эквивалента, моляльную концентрацию и титр этого раствора.
| Номер варианта | |||||||||||||
| Заданное соединение | KCN | CoCl2 | Na2SiO3 | NH4Cl | Na2CO3 | (NH4)2CO3 | CuSO4 | СН3СООK | NH4CN | FeI2 | K3PO4 | Al(NO3)3 | Ba(NO2)2 |
| СВ, моль/л | 0,5 | 0,3 | 1,5 | 0,6 | 0,4 | 1,2 | 1,1 | 0,9 | 0,2 | 0,7 | 0,1 | ||
| r, г/мл | 1,12 | 1,09 | 1,05 | 1,24 | 1,13 | 1,32 | 1,1 | 1,17 | 1,19 | 1,15 | 1,02 | 1,14 | 1,01 |
| номер варианта | |||||||||||||
| Заданное соединение | ZnSO4 | Cr(MnO4)3 | AlBr3 | K2SO3 | Na3AsO4, | CuCl2 | Na2S2O3, | KNO2 | NiSO4 | Na2S | MnBr2 | KClO | Fe(NO3)3 |
| СВ, моль/л | 1,4 | 2,5 | 1,6 | 0,45 | 1,9 | 0,8 | 0,04 | 1,7 | 1,3 | 0,26 | 0,03 | 0,27 | 0,46 |
| r, г/мл | 1,22 | 1,29 | 1,25 | 1,11 | 1,3 | 1,12 | 1,04 | 1,2 | 1,21 | 1,05 | 1,01 | 1,04 | 1,01 |
Задание 3.Рассчитайте ионную силу раствора, в котором содержится соль, указанная в вашем варианте (табл. 9) и BaCl2 c концентрацией 0,25 моль/кг.
4.2. КОЛИЧЕСТВЕННЫЙ АНАЛИЗ.
МЕТОД НЕЙТРАЛИЗАЦИИ
Теоретическая часть
Метод нейтрализации позволяет по результатам титрования определить точную концентрацию компонента кислотного или основного характера в исследуемом растворе и вычислить его содержание в граммах. В основе метода лежит реакция нейтрализации между кислотой и основанием, кислотой и основной солью, основанием и кислой солью и др., т.е. реакция взаимодействия гидратированных ионов Н + и ОН – : Н + + ОН – → Н2О.
Теоретической основой метода является закон эквивалентов: массы реагирующих веществ пропорциональны их молярным массам эквивалентов:
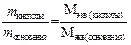
где mкислоты и mоснования – массы реагирующих веществ кислотно-основного характера, г; Мэкв – молярные массы эквивалентов взаимодействующих веществ, г/моль; Мэкв(В) = M(В) × fэкв.
Следствие из закона эквивалентов позволяет оперировать объемами реагирующих веществ:
где Сэкв –молярные концентрации эквивалентов реагирующих веществ, моль/л; V – объемы растворов реагирующих веществ, мл.
В качестве рабочих растворов в методе нейтрализации используют:
1) титрованный раствор HCl (или H2SO4) Cэкв = 0,1 или 0,01 моль/л;
2) титрованный раствор NaOH (или KOH) Cэкв = 0,1 или
0,01 моль/л;
3) установочный раствор буры (Na2B4O7×10H2O) (для установления титра кислоты);
4) установочный раствор щавелевой кислоты H2C2O4×2H2O (для установления титра щелочи).
Для установления точки эквивалентности в реакции нейтрализации используют индикаторы (метиловый оранжевый, фенолфталеин и др.). Например, для определения концентрации соляной кислоты в исследуемом растворе (Сэкв(HCl)) точный объем исследуемого раствора
(5 или 10 мл) переносят пипеткой в колбу для титрования и титруют из бюретки титрованным раствором щелочи с Сэкв = 0,1 моль/л до достижения эквивалентной точки, которая определяется по изменению цвета индикатора. Зная объем исследуемого раствора кислоты (Vисслед.к-ты), Сэкв(NaOH), экспериментально определив V(NaOH), определяют Сэкв(HCl):
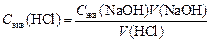
содержание компонента кислотного или основного характера в определенном объеме раствора в граммах можно определить:
б) 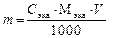
Зная Сэкв, всегда можно выразить концентрацию вещества в виде С(В), См, С% и Т.
Обучающие задачи
Задача 1. Сколько граммов натрия тетрабората (буры) –
Na2B4O7 10H2O надо взять, чтобы приготовить 250 мл Сэкв = 0,1 моль/л раствора для установления точной концентрации раствора HCl?
Запишем уравнения процесса нейтрализации буры соляной кислотой, учитывая, что натрия тетраборат подвергается в воде гидролизу с образованием NaOH, который затем вступает в реакцию с HCl:
а)
1. Определяем молярную массу эквивалента Na2B4O7 × 10H2O, учитывая, что:
2. Рассчитывают массу буры, необходимую для приготовления
250 мл раствора:
Взвешивают вычисленную навеску на аналитических весах, помещают ее в мерную колбу на 250 мл, растворяют и доливают водой до метки, закрывают пробкой и перемешивают. Получают 250 мл Сэкв =
= 0,1 моль/л раствора буры точной концентрации. Этот раствор называют в количественном объемном анализе «установочным» или «приготовленным» раствором, т.е. раствором с концентрацией, рассчитанной по точной навеске.
Задача 2. Определите молярную концентрацию эквивалента (Сэкв), титр, поправочный коэффициент (K) раствора HCl, если на титрование 10 мл его затрачено 10,4 мл Cэкв = 0,1 моль/л раствора буры?
1. Запишем уравнения реакций гидролиза и нейтрализации, в которые вступает натрия тетраборат:
2. Расчитаем молярную концентрацию эквивалента Сэкв раствора HCl по следствию закона эквивалентов:

3. Определяем молярную массу эквивалента НСl:
Мэкв(НСl) = М(НСl) × fэкв(НСl) = 36,5 г/ моль × 1=36,5 г/ моль.
4. Определяем титр раствора HCl:

5. Определяем поправочный коэффициент:

Задача 3. Вычислить граммовое содержание NaOH в 250 мл и титр рабочего раствора NaOH, если на титрование 10 мл этого раствора было израсходовано 8,5 мл щавелевой кислоты (H2C2O4 × 2H2O) с Сэкв =
= 0,1 моль/л
1. Записываем уравнение реакции нейтрализации:
2. Определяем фактор эквивалентности, молярную массу эквивалента H2C2O4×2H2O и NaOH:
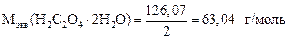
3. Определяем Сэкв раствора NaOH:


4. Определяем титр раствора NaOH:

5. Определяют граммовое содержание NaOH в 250 мл раствора:
m = V × T= 250 × 0,0034 = 0,85 г.
Задача 4. В колбе на 250 мл растворили 1 г технического реактива NaOH, на титрование 10 мл этого раствора пошло 8 мл раствора HCl с Сэкв = 0,1 моль/л, поправочный коэффициент K(Cэкв) = 0,95. Определить массовую долю (в %) NaOH в навеске.
1. Записываем уравнение реакции нейтрализации:
HCl + NaOH = NaCl + H2O.
2. Определяем молярные массы эквивалентов веществ, вступающих в реакцию:
Мэкв(HCl) = 36,5 г/моль; Мэкв(NaOH) = 40 г/моль.
3. Определяем практическую молярную концентрацию эквивалента (Cэкв) раствора HCl, зная поправочный коэффициент:
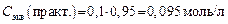
4. Расcчитываем Сэкв раствора NaOH:
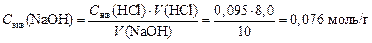
5. Определяем граммовое содержание NaOH в 250 мл раствора:
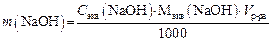

6. Определяем массовую долю (С%) NaOH (в %) в исследуемом образце:
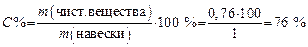
т.е. в техническом образце содержится 76 % химически чистого NaOH.
Задача 5. Сколько граммов KОН оттитровывается 8 мл HCl с Сэкв(HCl)теор = 0,1 моль/л K(Сэкв) = 0,98?
1. Записываем уравнение реакции и определяем молярные массы эквивалентов реагирующих веществ:
KОН + HCl = KCl + H2O;
Мэкв(KОН) = М(KОН) × fэкв(KОН) = 56 г/моль × 1 = 56 г/моль;
Мэкв(HCl) = М(HCl) × fэкв(HCl) = 36,5 г/моль × 1 = 36,5 г /моль.
2. Определяем практическую молярную концентрацию эквивалента раствора KОН:
3. Определяем содержание в граммах HCl в 8 мл раствора:
4. Определяем массу KОН, пошедшую на реакцию с HCl по закону эквивалентов:
4.2.3. Домашнее задание № 5
Задание 1.Рассчитайте, сколько граммов HCl оттитровываются раствором NaOH с заданными значениями Сэкв и объмом (см. свой вариант в табл. 10)
| Номер вари-анта | V, мл NaOH | Сэкв, моль/л NaOH | Номер вари-анта | V, мл NaOH | Сэкв, моль/л NaOH | Номер вари-анта | V, мл NaOH | Сэкв, моль/л NaOH |
| 0,2 | 0,2 | 0,55 | ||||||
| 0,5 | 0,4 | 0,45 | ||||||
| 0,55 | 0,6 | 0,3 | ||||||
| 0,3 | 0,25 | 0,1 | ||||||
| 0,1 | 0,2 | 0,6 | ||||||
| 0,25 | 0,5 | 0,3 | ||||||
| 0,35 | 0,7 | 0,6 | ||||||
| 0,4 | 0,3 | 0,5 | ||||||
| 0,5 | 0,4 |
Лабораторная работа № 4
ПРИГОТОВЛЕНИЕ РАСТВОРОВ ЗАДАННОЙ
КОНЦЕНТРАЦИИ. ТИТРИМЕТРИЧЕСКИЙ МЕТОД
Цель работы. Приобретение практических навыков в приготовлении растворов различной концентрации, в использовании титриметрического метода анализа для определения точной концентрации исследуемого раствора.
Опыт 1. Приготовление 30 г водного раствора кристаллогидрата натрия карбоната с массовой долей 15 %
Задание. Рассчитайте массу кристаллогидрата натрия карбоната Na2CO3·10H2O, которую необходимо взять для приготовления 30 г раствора с массовой долей 15 % в пересчете на безводную соль Na2CO3. Рассчитайте массу воды, необходимую для приготовления 30 г этого раствора. Все вычисления приведите в своем отчете (оформите задачей). Сделайте вывод (укажите, какими должны быть навеска кристаллогидрата соли и объем воды для приготовления раствора).
Выполнение опыта. Взвесьте на лабораторных технических весах навеску кристаллогидрата соли, которую получили в результате расчета, и количественно перенесите ее в стаканчик емкостью 50 мл. Мерным цилиндром отмерьте количество воды, которое необходимо для приготовления 30 г раствора. Влейте воду в станчик с солью (воду необходимо приливать постепенно, все время перемешивая раствор).
Опыт 2. Приготовление 100 мл водного раствора кристаллогидрата хлорида железа (III) концентрацией Сэкв = 0,5 моль/л
Задание. Рассчитайте навеску кристаллогидрата железа (III) хлорида FeCl3·6H2O, которую необходимо взять для приготовления 100 мл раствора с концентрацией Сэкв= 0,5 моль/л. Все вычисления приведите в своем отчете (оформите задачей). Сделайте вывод (укажите, какими должны быть навеска кристаллогидрата соли и объем воды для приготовления раствора).
Выполнение опыта. Взвесьте на лабораторных технических весах навеску кристаллогидрата и перенесите ее через воронку в мерную колбу на 100 мл. Ополаскивание воронки водой продолжайте до тех пор, пока вся навеска соли не будет перенесена в мерную колбу. Раствор в колбе должен при этом занимать примерно две третьих части ее объема. Если все кристаллы соли растворились, перемешайте раствор круговыми движениями колбы и после этого долейте его до метки дистиллированной водой. Закройте колбу пробкой и снова перемешайте раствор, переворачивая колбу вверх то дном, то горловиной.
Опыт 3. Установление точной концентрации соляной кислоты по буре
Для установления точной концентрации раствора кислоты используют натрия тетраборат (буру) Na2B4O7×10H2O, соль сильного основания (NaOH) и слабой кислоты (H3BO3), которая в водном растворе подвергается гидролизу, и раствор имеет щелочную реакцию:

Процесс гидролиза обратим, но при добавлении HCl ионы H + связываются с ОН – и гидролиз идет до конца.
Именно по этой причине эта соль может использоваться как основной компонент кислотно-основного взаимодействия в методе нейтрализации:
2HCl + 2NaOH = 2NaCl + 2H2O.
Суммарное уравнение взаимодействия буры с HCl:
Количество NaOH, образовавшегося при гидролизе буры, эквивалентно количеству взятой буры, а также количеству HCl, пошедшему на нейтрализацию NaOH. Поэтому по количеству буры, пошедшей на титрование, можно определить точную концентрацию раствора HCl.
В конце реакции накапливается слабая борная кислота, следовательно, pH раствора в точке эквивалентности будет несколько меньше 7 и для титрования следует взять индикатор метиловый оранжевый.
а) Приведите в рабочее состояние бюретку, налейте в нее до отметки «0» приготовленный вами или лаборантами раствор HCl с приблизительной концентрацией Сэкв = 0,1 моль/л.
б) В стаканчик для титрования с помощью другой бюретки (наполненной раствором буры) отмерьте 5 мл раствора буры с Сэкв =
= 0,1 моль/л, добавьте 1 – 2 капли метилового оранжевого, раствор тщательно перемешайте, он приобретет желтый цвет.
в) К раствору буры медленно, небольшими порциями из бюретки приливайте раствор соляной кислоты до точки эквивалентности. При этом окраска метилоранжа переходит из желтой в бледно-розовую.
г) Заметьте по бюретке объем соляной кислоты, пошедшей на титрование. Титрование повторите три раза. Данные титрования занесите в табл. 11.
Задание. Запишите уравнение реакции. Заполните таблицу.
а) На основании уравнения для следствия закона эквивалентов:
Cэкв(буры)´V(буры) = Сэкв(HCl) ´ V(HCl) расчитайте Сэкв(HCl), взяв Vср(HCl) как среднее значение по результатам трех титрований.
б) Определите титр раствора соляной кислоты, используя формулу
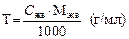
в) Определите поправочный коэффициент (K) для исследуемого раствора HCl, учитывая, что Cэкв (теор) = 0,1 моль/л.
4.3. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ.
РАВНОВЕСИЕ В ВОДНЫХ РАСТВОРАХ
ЭЛЕКТРОЛИТОВ
Теоретическая часть
Электролитами называют вещества, которые в растворенном (или расплавленном) состоянии проводят электрический ток. Теория Аррениуса объясняет электропроводность растворов тем, что молекулы электролитов под действием полярных молекул растворителя диссоциируют на ионы. Эта способность электролитов к диссоциации на ионы служит мерой силы данного электролита. При растворении в полярных растворителях молекулы многих веществ практически полностью распадаются на ионы. Такие вещества называются сильными электролитами (NaCl, Na2SO4, HCl, KOH и др.). Однако электролитическая диссоциация многих других веществ в аналогичных условиях не доходит до конца. Процесс оказывается обратимым, причем равновесие наступает при распаде на ионы лишь небольшой части молекул, находящихся в растворе. Вещества подобного рода называются слабыми электролитами (СН3СООН, Н2СО3, NH4OH и др.). Отношение числа молекул, диссоциированных на ионы, к суммарному числу диссоциированных и недиссоциированных молекул называют степенью электролитической диссоциации, которую измеряют либо в долях единицы, либо в процентах.

Для сильных электролитов a > 30 %, для слабых a – ]×[Н + ].
В растворе быстро устанавливается равновесие между процессами диссоциации и ассоциации, т.е. cкорости прямой и обратной реакции будут равны: v 1 = v2 или k1 × [СН3СООН] = k2 × [СН3СОО – ] × [Н + ].
Преобразование последнего уравнения позволит выразить константу равновесия реакции диссоциации следующим образом:

Для растворов слабых бинарных электролитов Оствальд установил взаимосвязь между константой диссоциации (Kдис), степенью диссоциации (a) и молярной концентрацией раствора (СВ).
Рассмотрим эту взаимозависимость на примере диссоциации уксусной кислоты. Полагая, что количество диссоциированных молекул кислоты и, следовательно, концентрация каждого из образовавшихся ионов Н + и СН3СОО – в момент установления равновесия в системе равна [Н + ] = [СН3СОО – ] = СB·a. Тогда равновесная концентрация недиссоциированных молекул будет равна [СН3СООH] = СB – СB·a =
= СB·(1 – a). Подставив эти значения концентраций ионов и молекул в уравнение константы равновесия реакции диссоциации СН3СООН, получим


Это уравнение является математическим выражением закона разведения Оствальда. Поскольку степень диссоциации у слабых электролитов мала, то можно пренебречь этой величиной в знаменателе как слагаемым (им нельзя пренебречь в числителе как множителем). Тогда
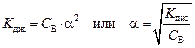
Закон разведения Оствальда формулируется следующим образом.