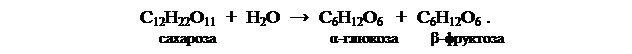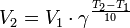Что называется молекулярностью реакции
МОЛЕКУЛЯРНОСТЬ РЕАКЦИИ
Смотреть что такое «МОЛЕКУЛЯРНОСТЬ РЕАКЦИИ» в других словарях:
молекулярность реакции — – число частиц (атомов, молекул или ионов), одновременно участвующих в элементарном акте химического превращения. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
молекулярность реакции — reakcijos molekulingumas statusas T sritis chemija apibrėžtis Dalelių, dalyvaujančių elementariajame reakcijos akte, skaičius. atitikmenys: angl. molecularity of reaction rus. молекулярность реакции … Chemijos terminų aiškinamasis žodynas
МОЛЕКУЛЯРНОСТЬ РЕАКЦИИ — число частиц (молекул, радикалов, ионов), подвергающихся превращению в элементарном акте простой хим. реакции; может составлять 1, 2 или 3 (редко). Соотв. различают мопомол,, бимол. и тримол. реакции. Как правило, М.р. совпадает с порядком… … Естествознание. Энциклопедический словарь
Реакции химические — превращения одних веществ в другие, отличные от исходных по химическому составу или строению. Общее число атомов каждого данного элемента, а также сами химические элементы, составляющие вещества, остаются в Р. х. неизмененными; этим Р. х … Большая советская энциклопедия
химические реакции — [chemical reactions] превращение одних веществ в другие, отличные от исходных по химическому составу или строению. Общее число атомов каждого данного элемента, а также сами химические элементы, составляющим вещества, остаются в химической реакции … Энциклопедический словарь по металлургии
закон скорости реакции — (закон действующих масс): при постоянной температуре скорость элементарной гомогенной реакции, для которой молекулярность совпадает с порядком, прямопропорциональна произведению концентраций реагирующих веществ в степенях, равных… … Химические термины
Химическая кинетика — Эта статья или раздел нуждается в переработке. Пожалуйста, улучшите статью в соответствии с правилами написания статей … Википедия
ХИМИЧЕСКАЯ КИНЕТИКА И ХИМИЧЕСКОЕ РАВНОВЕСИЕ — Скорость любой химической реакции зависит от условий, в которых она протекает: от концентрации реагентов (или их давления, если это газы), температуры, наличия катализатора или излучения и т.д. Одни реакции протекают практически мгновенно… … Энциклопедия Кольера
molecularity of reaction — reakcijos molekulingumas statusas T sritis chemija apibrėžtis Dalelių, dalyvaujančių elementariajame reakcijos akte, skaičius. atitikmenys: angl. molecularity of reaction rus. молекулярность реакции … Chemijos terminų aiškinamasis žodynas
reakcijos molekulingumas — statusas T sritis chemija apibrėžtis Dalelių, dalyvaujančių elementariajame reakcijos akte, skaičius. atitikmenys: angl. molecularity of reaction rus. молекулярность реакции … Chemijos terminų aiškinamasis žodynas
Молекулярность и порядок химических реакций;
Для характеристики элементарных химических реакций используют понятие о молекулярности. Она может характеризоваться только целыми числами.
Молекулярность реакции определяется числом частиц (молекул), одновременно участвующих в элементарном акте химического взаимодействия. Если в элементарном акте взаимодействия участвует одна молекула, превращающаяся в одну или несколько молекул других веществ (реакции изомеризации, термического разложения, дегидратации в органической химии и т.д.), то такая реакция называется мономолекулярной.
А→продукты реакции (14.7)
Ca(HCO3)2
Бимолекулярными называются такие реакции, в которых в одновременном элементарном акте химического взаимодействия участвуют две
молекулы.
А + В → продукты реакции
или 2А → продукты реакции. (14.8)
CH3COOH + C2H5OH 
Тримолекулярными – называются такие реакции, элементарный акт которых сводится к одновременному столкновению и химическому взаимодействию трех молекул. Их немного.
2А+В → продукты реакции, (14.9)
или 3А → продукты реакции.
Реакции с молекулярностью выше трех неизвестны, так как крайне мала вероятность столкновения и химического взаимодействия четырех молекул.
Окислительно-восстановительные химические реакции с большими
стехиометрическими коэффициентами, протекают по отдельным стадиям по типу моно-, би-, и тримолекулярных реакций.
Порядок реакции – это число, равное сумме показателей степеней концентраций реагирующих веществ в уравнении ЗДМ для скорости реакции:
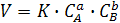
Общий порядок химической реакции а+b.
Порядок и молекулярность могут совпадать и различаться. В отличие от молекулярности порядок бывает дробным и даже отрицательным и нулевым.
Эта реакция имеет формально второй порядок.
Иногда порядок меняется в ходе химического процесса:
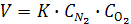
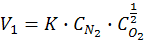
порядок согласно второму уравнению не 2, а 1,5. Возможен и нулевой порядок. Он означает, что скорость химической реакции при Т=const постоянна и не зависит от концентрации реагента.
Иногда порядок реакции ниже кажущейся молекулярности потому, что количество одного из реагентов, являющегося средой, в ходе химического превращения остается постоянным:
Это псевдомономолекулярная реакция первого порядка.
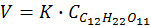
Эта бимолекулярная реакция является псевдомономолекулярной, т. к. концентрация воды в ходе реакции практически не меняется, и константа скорости инверсии может быть рассчитана по кинетическому уравнению реакции первого порядка.
Гидролиз тростникового сахара в нейтральном водном растворе практически не идет, он катализируется ионами водорода. Скорость гомогенного каталитического процесса пропорциональна концентрации катализатора (ионов водорода) в растворе.
Сахароза и продукты ее гидролиза принадлежат к числу оптически активных веществ, что связано с наличием в их молекулах асимметричных атомов углерода. Оптические изомеры отличаются по строению друг от друга, как несимметричный предмет от своего зеркального изображения. По физическим и химическим свойствам такие молекулы одинаковы и отличаются только различным по направлению вращением плоскости поляризации света.
Электромагнитные колебания естественного света происходят во всех плоскостях, проходящих через световой луч, колебания поляризованного света происходят лишь в одной из таких плоскостей.
Плоскость, перпендикулярная к плоскости колебаний поляризованного луча (также проходящая через луч), называется плоскостью поляризации. При пропускании поляризованного света через раствор оптически деятельного вещества плоскость поляризации поворачивается. Угол смещения плоскости колебаний поляризованного луча называется углом вращения плоскости поляризации.
Для растворов установлен следующий количественный закон: угол вращения плоскости поляризации а прямо пропорционален толщине слоя раствора d и концентрации активного вещества С:
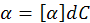
где d – это толщина слоя раствора, через который проходит поляризованный луч, дм;
С – концентрация, г/см 3 ;
Удельное вращение плоскости поляризации в водных растворах сахарозы постоянно [α]=+66,55°, поэтому, зная угол вращения и толщину слоя раствора, легко найти концентрацию сахарозы.
Тростниковый сахар вращает плоскость поляризации вправо [α]=+66,55°, а смесь продуктов гидролиза – влево, так как фруктоза вращает ее влево [α]= 91,9° и больше, чем глюкоза, которая вращает вправо [α]=+52,5°. Поэтому по мере протекания гидролиза угол вращения плоскости поляризации уменьшается, падает до нуля, а затем становится отрицательным, т.е. правое вращение сменяется левым. Поэтому гидролиз тростникового сахара называют инверсией. Окончанию инверсии отвечает отрицательное предельное значение угла вращения.
Молекулярность и порядок реакции



Основной закон химической кинетики.
Элементарной называют реакцию прямого превращения молекул исходных веществ в молекулы продуктов реакции. Элементарная реакция состоит из большого числа однотипных элементарных актов химического превращения.
Число молекул, участвующих в элементарном акте химического превращения, называют молекулярностьюреакции 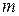
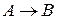
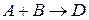
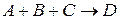
Молекулярность реакции равна сумме стехиометрических коэффициентов, выражающих число молекул, участвующих в элементарном акте химического превращения. Так для бимолекулярной реакции (210) 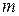
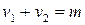
Таким образом, молекулярность реакции равна: 1, 2 и реже 3.
Экспериментально установлен основной закон химической кинетики или закон действия масс:
скорость элементарной химической реакции прямопропорциональна произведению концентраций молекул реагирующих веществ в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Если реакция (210) выражает элементарный акт химического взаимодействия, то скорость реакции можно выразить:
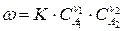
Большинство химических реакций являются сложными и включают несколько элементарных стадий химического превращения, каждая из которых может быть моно-, би- или реже тримолекулярной. Стадии могут сильно различаться по своим скоростям. Самая медленная стадия химической реакции определяет скорость процесса и называется лимитирующей. Лимитирующая стадия может быть одна, или их может быть несколько, когда две или несколько стадий протекают с близкими скоростями.
Если механизм реакции не изучен и лимитирующая стадия не выявлена, то закон действия масс (211) применяют формально для описания скорости сложных реакции. Если уравнение (210) отражает протекание сложной реакции, то ее скорость можно выразить:
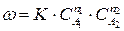
где 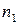
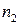
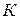
Сумму частных порядков 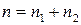
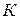
Размерность константы скорости включает время протекания процесса и меняется в зависимости от порядка реакции:
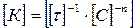
Молекулярность реакции



Молекулярность элементарной реакции — число частиц, которые, согласно экспериментально установленному механизму реакции, участвуют в элементарном акте химического взаимодействия.
Мономолекулярные реакции — реакции, в которых происходит химическое превращение одной молекулы (изомеризация, диссоциация и т. д.):
Бимолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении двух частиц (одинаковых или различных):
Тримолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении трех частиц:
Реакции с молекулярностью более трёх неизвестны.
Для элементарных реакций, проводимых при близких концентрациях исходных веществ, величины молекулярности и порядка реакции совпадают. Чётко определенной взаимосвязи между понятиями молекулярности и порядка реакции нет, так как порядок реакции характеризует кинетическое уравнение реакции, а молекулярность — механизм реакции.
17. Правило Вант-Гоффа — эмпирическое правило, позволяющее в первом приближении оценить влияние температуры на скорость химической реакции в небольшом температурном интервале (обычно от 0 °C до 100 °C). Я. Х. Вант-Гофф на основании множества экспериментов сформулировал следующее правило:
| При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза. |
Уравнение, которое описывает это правило следующее:
где 
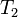

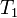

Следует помнить, что правило Вант-Гоффа применимо только для реакций с энергией активации 60-120 кДж/моль в температурном диапазоне 10-400 o C. Правилу Вант-Гоффа также не подчиняются реакции, в которых принимают участие громоздкие молекулы, например белки в биологических системах. Температурную зависимость скорости реакции более корректно описывает уравнение Аррениуса.
Из уравнения Вант-Гоффа температурный коэффициент вычисляется по формуле:
Уравне́ние Арре́ниуса устанавливает зависимость константы скорости химической реакции 

Согласно простой модели столкновений химическая реакция между двумя исходными веществами может происходить только в результате столкновения молекул этих веществ. Но не каждое столкновение ведёт к химической реакции. Необходимо преодолеть определённый энергетический барьер, чтобы молекулы начали друг с другом реагировать. То есть молекулы должны обладать некой минимальной энергией (энергия активации 
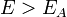
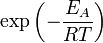
Здесь 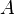

В рамках теории активных соударений 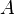
Оценки этого параметра показывают, что изменение температуры в диапазоне от 200 °C до 300 °C приводит к изменению частоты столкновений 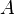
В рамках теории активированного комплекса получаются другие зависимости 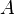
Уравнение Аррениуса стало одним из основных уравнений химической кинетики, а энергия активации — важной количественной характеристикой реакционной способности веществ.
Энергия активации в химии и биологии — минимальное количество энергии, которое требуется сообщить системе (в химии выражается в джоулях на моль), чтобы произошла реакция. Термин введён Сванте Августом Аррениусом в 1889. Типичное обозначение энергии реакции Ea.
Ката́лиз (греч. — разрушение) — избирательное ускорение одного из возможных термодинамически разрешенных направлений химической реакции под действием катализатора(ов), который многократно вступает в промежуточное химическое взаимодействие с участниками реакции и восстанавливает свой химический состав после каждого цикла промежуточных химических взаимодействий.
Типы катализа.По влиянию на скорость реакции катализ многие источники делят на положительный (скорость реакции растет) и отрицательный (скорость реакции падает). В последнем случае происходит процесс ингибирования, который нельзя считать ‘отрицательным катализом’, поскольку ингибитор в ходе реакции расходуется.
Катализ бывает гомогенным и гетерогенным (контактным). В гомогенном катализе катализатор состоит в той же фазе, что и реактивы реакции, в то время, как гетерогенные катализаторы отличаются фазой.
Гомогенный катализ.Примером гомогенного катализа является разложение пероксида водорода в присутствии ионов йода. Реакция протекает в две стадии:
При гомогенном катализе действие катализатора связано с тем, что он вступает во взаимодействие с реагирующими веществами с образованием промежуточных соединений, это приводит к снижению энергии активации
Гетерогенный катализ. При гетерогенном катализе ускорение процесса обычно происходит на поверхности твердого тела — катализатора, поэтому активность катализатора зависит от величины и свойств его поверхности. На практике катализатор обычно наносят на твердый пористый носитель.
Механизм гетерогенного катализа сложнее, чем у гомогенного. Механизм гетерогенного катализа включает пять стадий, причем все они обратимы.
1. Диффузия реагирующих веществ к поверхности твердого вещества
2. Физическая адсорбция на активных центрах поверхности твердого вещества реагирующих молекул и затем хемосорбция их
3. Химическая реакция между реагирующими молекулами
4. Десорбция продуктов с поверхности катализатора
5. Диффузия продукта с поверхности катализатора в общий поток
Примером гетерогенного катализа является окисление SO2 в SO3 на катализаторе V2O5 при производстве серной кислоты (контактный метод).
Химия катализа изучает вещества, изменяющие скорость химических реакций. Вещества, замедляющие реакции, называютсяингибиторами. Ферменты — это биологические катализаторы. Катализатор не находится в стехиометрических отношениях с продуктами и регенерируется после каждого цикла превращения реагентов в продукты. Несмотря на появление новых способов активации молекул (плазмохимия, радиационное и лазерное воздействия и другие), катализ − основа химических производств (относительная доля каталитических процессов составляет 80-90 %).
Реакция, накормившая человечество (решение проблемы связанного азота) — цикл Габера-Боша. Аммиак получают с катализатором — пористым железом. Протекает при Р = 30 МПа и Т = 420—500 °C
Водород для синтеза NH3 получают путем двух последовательных каталитических процессов: конверсии СН4(СН4 + Н2О → СО + 3Н2) на Ni − катализаторах и конверсии образующегося оксида углерода (СО + Н2О → СО2 + Н2). Для достижения высоких степеней превращения последнюю реакцию осуществляют в две стадии: высокотемпературная (315—480 °C) — на Fe − Cr − оксидных катализаторах и низкотемпературная (200—350 °C) — на Cu − Zn − оксидных катализаторах. Из аммиака получают азотную кислоту и другие соединения азота — от лекарств и удобрений до взрывчатых веществ.
Различают катализы »гомогенный, гетерогенный, межфазный, мицеллярный, ферментативный.
Энергия активации E каталитических реакций значительно меньше, чем для той же реакций в отсутствие катализатора. Например, для некаталитического разложения NH3 на N2 + Н2 E
320 кДж/моль, для того же разложения в присутствии Pt Е
150 кДж/моль. Благодаря снижению E обеспечивается ускорение каталитических реакций по сравнению с некаталитическими.
Главным положением теории гомогенных каталитических реакций является представление об образовании неустойчивых промежуточных соединений катализатора с реагирующими веществами, с последующим распадом этих соединений и регенерацией катализатора.
Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем
Конста́нта равнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальными давлениями, концентрациями или фугитивностями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции.
Зависимость константы равновесия реакции от температуры может быть описана уравнением изобары химической реакции (изобары Вант-Гоффа):
и изохоры химической реакции (изохоры Вант-Гоффа):
Здесь 

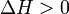

Принцип Ле Шателье — Брауна (1884 г.) — если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация, внешнее электромагнитное поле), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
Влияние давления. Давление существенно влияет на положение равновесия в реакциях с участием газообразных веществ, сопровождающихся изменением объёма за счёт изменения количества вещества при переходе от исходных веществ к продуктам:
При повышении давления равновесие сдвигается в направлении, в котором уменьшается суммарное количество молей газов и наоборот.
В реакции синтеза аммиака количество газов уменьшается вдвое: N2 + 3H2 ↔ 2NH3
Значит, при повышении давления равновесие смещается в сторону образования NH3, о чём свидетельствуют следующие данные для реакции синтеза аммиака при 400 °C:
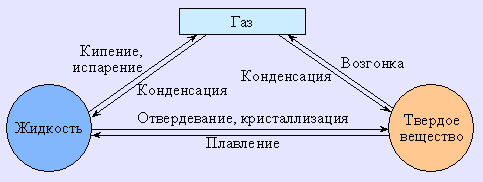
Равновесия между различными фазами одной системы называют фазовыми, а описывают эти фазовые равновесия посредством фазовых диаграмм или диаграмм состояния. Фазовая диаграмма позволяет установить условия равновесия между числом фаз, числом компонентов и числом степеней свободы (вариантностью) системы.
Фаза (Ф) – гомогенная (однородная по химическому составу и термодинамическим свойствам) часть системы, отделенная от других частей поверхностью раздела. Так, два нерастворимых друг в друге твердых вещества, как и две несмешивающиеся жидкости, образуют две фазы.
Компоненты (К) – химически индивидуальные вещества, наименьшее число которых достаточно для образования фаз системы.
Число компонентов определяется количеством индивидуальных веществ в системе за вычетом числа возможных между ними обратимых взаимодействий. Например, система из трех индивидуальных веществ H2O, H2, O2 будет двухкомпонентной, поскольку для образования всех фаз достаточно любых двух веществ:
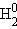 = H2 + 1/2O2. = H2 + 1/2O2. |
По числу компонентов системы делятся на одно-, двух-, трех- и многокомпонентные.
Степени свободы (С) – число параметров (температура, давление, состав системы), которые можно произвольно менять без изменения числа фаз в системе.
Правило фаз Гиббса: в изолированной равновесной системе число степеней свободы равно числу компонентов системы плюс два минус число фаз:
В качестве примера однокомпонентной системы, для которой правило фаз С = 3 – Ф, на рис. 6.10 приведена фазовая диаграмма диоксида углерода.