Что находится в синаптических пузырьках
Что находится в синаптических пузырьках
Цитоархитектоника головного мозга человека организована таким образом, что более чем 10 млрд. нервных клеток, занимая относительно небольшое пространство и будучи сформированными в специализированные структуры, обеспечивают специфические функции мозга, связанные с восприятием, переработкой и проведением информации, в соответствии с которой осуществляется взаимодействие организма с внешней средой на основе высокой нейрональной специфичности и пластичности.
Основной структурной единицей нервной системы является нейрон. Различные типы нейронов дифференцируются по величине и форме тела клетки, а также по длине и степени ветвистости ее отростков.
Клеточное тело по своим размерам варьирует очень широко — от 5 до 100 мкм в диаметре. Оно содержит следующие органеллы: ядро, митохондрии, эндоплазматический ретикулум (гладкий и шероховатый), расположенные на цистернах эндоплазматического ретикулума и в свободном пространстве рибосомы и полисомы, комплекс Гольджи и различные внутриклеточные включения (гранулы гликогена, липидные капли, скопления частиц пигмента в особых нейронах и др.), везикулы, а также лизосомы. Группы параллельно расположенных цистерн шероховатого эндоплазматического ретикулума в виде ограниченных мембраной удлиненных цистерн с прикрепленными к ним рибосомами образуют субстанцию (тельца) Ниссля (тигроидное вещество). В цитоплазме имеются также нейрофиламенты и нейротрубочки (рис. 3).
Все перечисленные ультраструктурные органеллы клетки несут определенные функции. Ядро является субстратом основных генетических процессов в клетке. Митохондрии обеспечивают энергетический обмен — в них происходит окислительное фосфорилирование, приводящее к продукции энергии в виде молекул АТФ. Эндоплазматический ретикулум с прикрепленными на его цистернах рибосомами, а также свободно расположенные рибосомы и их комплексы (полисомы) имеют отношение к белковому обмену и синтетическим процессам в клетке. Лизосомам приписывается обменно-выделительная роль. Нейротрубочки и нейрофиламенты обеспечивают транспорт внутриклеточных веществ, имеющих отношение к проведению нервного импульса. Долгое время считали, что комплекс Гольджи, состоящий из параллельно расположенных цистерн и скоплений пузырьков на их концах, выполняет неопределенные обменно-выделительные функции. Хотя об этом комплексе известно далеко не все, привлекают к себе накопленные многими исследователями данные, свидетельствующие о том, что он играет главную роль в процессах обновления клеточной мембраны и ее генетически обусловленной специализации. Известно, что в комплексе Гольджи может происходить первичная сборка специализированных участков мембраны (рецепторов), которые в виде пузырьков транспортируются к наружной клеточной оболочке и встраиваются в нее. Такие исследования были обобщены А.А.Милохиным (1983).
От тела нейрона отходят основной отросток — аксон и многочисленные ветвящиеся отростки — дендриты. Длина аксонов различных нейронов колеблется от 1 мм до почти 1 м (нервное волокно). Вблизи окончания аксон разделяется на терминали, на которых расположены синапсы, контактирующие с телом и дендритами других нейронов. Синапсы вместе с нейрофиламентами и нейротрубочками являются субстратом проведения нервного импульса.
Рис. 3. Основные ультраструктурные компоненты нейрона.
Л — лизосомы; ШЭР — шероховатый эндоплазматический ретикулум (цистерны с прикрепленными рибосомами); М — митохондрии; НФ — нейрофиламенты; НТ — нейротрубочки; P — рибосомы; П — полисомы (комплексы рибосом); КГ — комплекс Гольджи; Я — ядро; ЦЭР — цистерны эндоплазматического ретикулума; ЛГ — липидные гранулы; ЛФ — липофусцин.
Кроме нейронов, в ткани мозга имеются различные виды глиальных клеток — астроглия, олигодендроглия, микроглия. Астроглия играет большую роль в обеспечении функции нейрона и формировании реакции мозговой ткани на вредоносные воздействия (инфекция, интоксикация и др.) — принимает участие в воспалительных процессах и ликвидации их последствий (заместительный глиоз). Олигодендроглия, как известно, обеспечивает миелинизацию нервного волокна и регулирует водный обмен (дренажная глия). Функции микроглии не до конца изучены, но ее значение подчеркивается размножением этих клеток при некоторых специфических процессах (участие в формировании сенильных бляшек; существует предположение о выработке микроглиальными клетками амилоидных фибрилл и т.п.).
Особые клеточные структуры характерны для желудочковых поверхностей головного мозга и его сосудистого сплетения. Желудочковая поверхность мозга покрыта клетками эпендимы с многочисленными микроворсинками и ресничками, принимающими участие в ликворообращении; сосудистое сплетение представлено «гроздьями» ворсинок, состоящих из капилляров, покрытых эпителиальными клетками. Их основная функция связана с обменом веществ между кровью и цереброспинальной жидкостью.
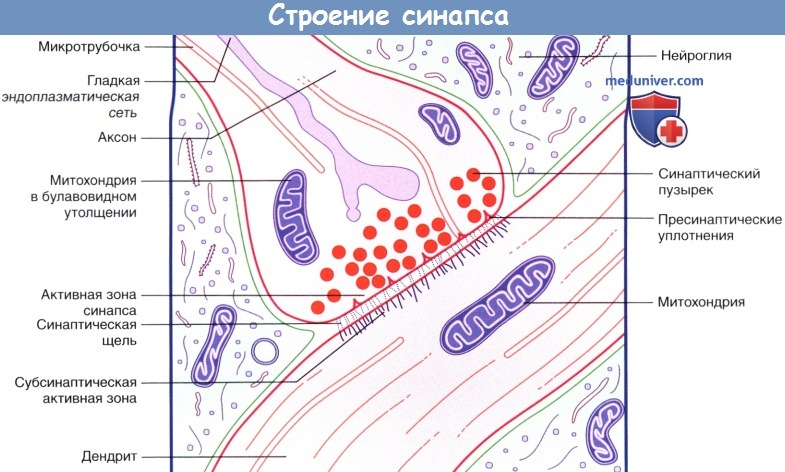
Типичный синапс состоит из пресинаптической терминали, постсинаптической области и расположенной между ними синаптической щели. Пресинаптическая терминаль является окончанием аксона. Она содержит нейрофиламенты, нейротрубочки, митохондрии и синаптические пузырьки, скопления которых видны около пресинаптической мембраны. Через последнюю переносятся содержащиеся в пузырьках нейротрансмиттеры. Постсинапс характеризуется наличием постсинаптического утолщения. Постсинаптическое утолщение представлено мембраной клетки с расположенными на ней рецепторами, входящими в структуру самой мембраны. Синапс представлен на рис. 4, а его электронно-микроскопическая картина на рис. 5.
Синапс может быть расположен на теле (соме) клетки — аксосоматический синапс, на дендрите — аксодендритный, на шипике дендрита — аксошипиковый (рис. 6) и на аксоне другой клетки — аксо-аксональный. Аксошипиковые синапсы несколько отличаются по своему строению от типичного синапса, что определяется строением шипика, имеющего в составе постсинапса особый шипиковый аппарат.
Взаимодействие пресинапса и постсинапса обеспечивается благодаря переносу нейротрансмиттера через синаптическую щель. Выделяясь из пресинапса, нейротрансмиттер (медиатор) может связываться с рецептором постсинаптической мембраны, инактивироваться в синаптической щели и частично вновь захватываться пресинаптической мембраной (процесс обратного захвата — reuptake ). Если рецептор постсинаптической мембраны заблокирован, то возможны оба последних процесса, а также избыточное накопление медиатора и связанное с этим развитие гиперчувствительности рецепторов (см. рис. 4).
Более подробно эти процессы рассматриваются в разделе «Нейрохимические системы мозга».
Рецепторы нейронов — это белковые структуры, расположенные на внешней поверхности мембраны клеток. Они способны «распознавать» и связывать биологически активные вещества — нейротрансмиттеры, различные эндогенные вещества, а также экзогенные соединения, в том числе психофармакологические средства. Соединения, которые могут связывать рецепторы, называются лигандами. Лиганды бывают эндогенными и экзогенными.
Распознавание лиганда рецептором обеспечивается специальными структурными элементами, или сайтами. Специфичность связывания лиганда происходит благодаря структурному соответствию молекул лиганда и рецептора, когда они подходят друг к другу по типу «ключ к замку». Реакция связывания является моментом запуска каскада внутриклеточных реакций, приводящих к изменению функционального состояния нейрона. В зависимости от «силы» и «прочности» связывания лиганда с рецептором употребляют понятие аффинности (сродства) лиганда по отношению к рецептору.
При связывании рецептора с лигандом может происходить как активация, так и блокада рецептора. В связи с этим говорят об агонистах и антагонистах рецепторов, а также о частичных агонистах (рис. 7).
Максимальную эффективность в отношении активации рецептора имеет полный агонист, минимальную (практически нулевую) — антагонист. Между ними находятся вещества, называемые частичными агонистами. Последние действуют значительно мягче, чем полные агонисты. Частичные агонисты, кроме того, занимая определенное пространственное положение в молекуле рецептора, могут предотвращать избыточное действие полного агониста, т.е. действуют частично как антагонисты. В этом случае употребляют понятие агонист/антагонист.
Высокой аффинностью могут обладать как агонисты, так и антагонисты рецептора. Агонист активирует рецептор, вызывая соответствующий физиологический эффект, в то время как антагонист, связываясь с рецептором, блокирует его и предотвращает развитие физиологического эффекта, выявляемого агонистами. Примером антагонистов могут служить нейролептики, которые предотвращают эффекты дофамина на уровне дофаминового рецептора.
При связывании лиганда с рецептором происходит изменение конфигурации последнего (рис. 7).
Многие вещества, как эндогенные, так и экзогенные, реагируют не с одним, а с несколькими типами рецепторов — «семейством» их, которое подразделяется на отдельные типы. Примером могут служить многие нейротрансмиттеры, реагирующие с несколькими типами специфических рецепторов (например, Д1—Д5-типы дофаминовых рецепторов). Существование нескольких рецепторов к одному лиганду носит название гетерогенности рецепторов.
Представление о функции рецепторов было бы неполным, если не представить внутриклеточные процессы, развивающиеся после связывания рецептора соответствующим веществом, и механизмы, обеспечивающие трансформацию внешнего сигнала в процессы, приводящие к появлению нервного импульса. Связывание лиганда с рецептором может приводить либо непосредственно к открытию (или закрытию) соответствующих ионных каналов (см. рис. 7), либо к активации вторичных мессенджерных систем (в качестве первичного мессенджера рассматривается вещество, реагирующее с рецептором).
Позднее были открыты и другие вторичные мессенджеры. Сейчас выделяют среди них 3 класса: 1) циклические нуклеотиды (цАМФ, циклический гуанозинмонофосфат — цГМФ); 2) ионы кальция (Са 2+ ); 3) метаболиты фосфолипидов — инозитол-1,4,5-трифосфат (1Р 3 ), диглицерин (ДАГ), арахидоновую кислоту. В отличие от других вторичных мессенджеров Са 2+ транспортируется в нейрон из внутриклеточного пространства.
Что находится в синаптических пузырьках
Область контакта между двумя нейронами называют синапсом.
а) Электрические синапсы. Электрические синапсы в нервной системе млекопитающих встречаются редко. Они образованы щелевидными контактами (нексусами) между дендритами или сомами соприкасающихся нейронов, которые соединяются с помощью цитоплазматических каналов диаметром 1,5 нм. Процесс передачи сигнала происходит без синаптической задержки и без участия медиаторов.
Посредством электрических синапсов возможно распространение электротонических потенциалов от одного нейрона к другому. Вследствие тесного синаптического контакта модуляция проведения сигнала невозможна. Задача этих синапсов — осуществление одновременного возбуждения нейронов, выполняющих одинаковую функцию. Примером служат нейроны дыхательного центра продолговатого мозга, которые во время вдоха синхронно генерируют импульсы. Кроме того, примером могут служить нейронные цепи, управляющие саккадами, при которых точка фиксации взора перемещается от одного объекта внимания к другому.
б) Химические синапсы. Большинство синапсов нервной системы — химические. Функционирование таких синапсов зависит от высвобождения медиаторов. Классический химический синапс представлен пресинаптической мембраной, синаптической щелью и постсинаптической мембраной. Пресинаптическая мембрана — часть булавовидного расширения нервного окончания клетки, передающей сигнал, а постсинаптическая мембрана — часть клетки, получающей сигнал.
Медиатор высвобождается из булавовидного расширения посредством экзоцитоза, проходит через синаптическую щель и связывается с рецепторами на постсинаптической мембране. Под постсинаптической мембраной расположена субсинаптическая активная зона, в которой после активации рецепторов постсинаптической мембраны происходят разнообразные биохимические процессы.
В булавовидном расширении расположены содержащие медиаторы синаптические пузырьки, а также большое количество митохондрий и цистерны гладкой эндоплазматической сети. Применение традиционных методик фиксации при исследовании клеток позволяет различить на пресинаптической мембране пресинаптические уплотнения, ограничивающие активные зоны синапса, к которым при помощи микротрубочек направляются синаптические пузырьки.
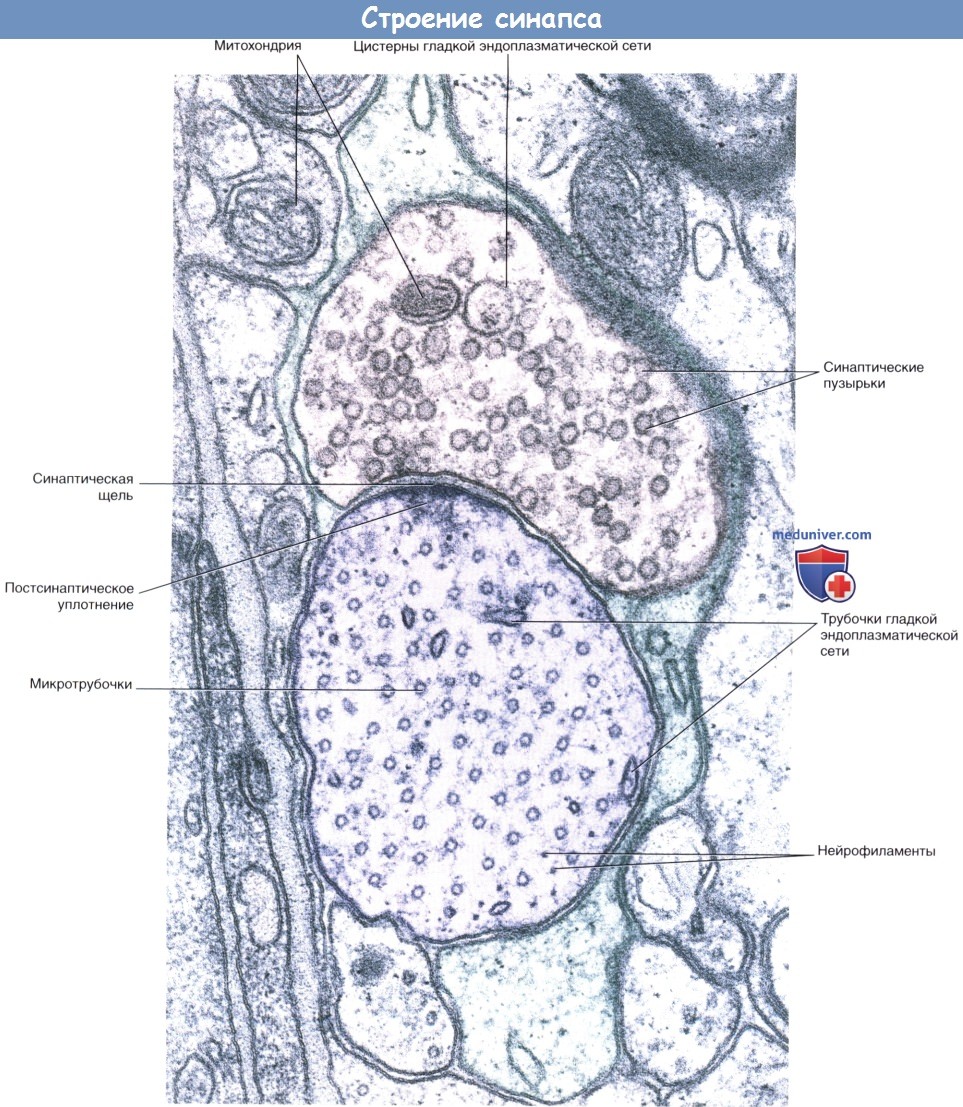
Срез препарата спинного мозга: синапс между концевым участком дендрита и, предположительно, двигательным нейроном.
Наличие округлых синаптических пузырьков и постсинаптического уплотнения характерно для возбуждающих синапсов.
Срез дендрита проведен в поперечном направлении, о чем свидетельствует наличие множества микротрубочек.
Кроме того, видны некоторые нейрофиламенты. Участок синапса окружен протоплазматическим астроцитом. 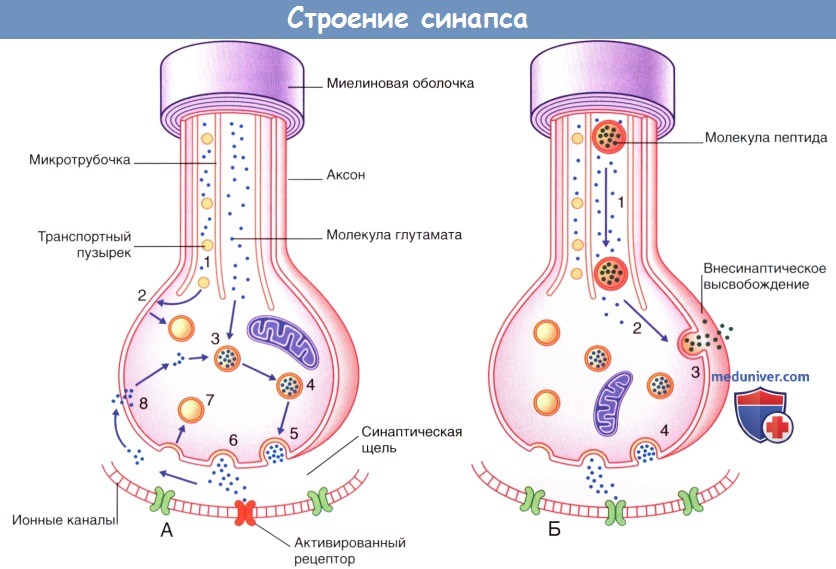
(А) Синаптическая передача небольших молекул (например, глутамата).
(1) Транспортные пузырьки, содержащие мембранные белки синаптических пузырьков, направляются вдоль микротрубочек к плазматической мембране булавовидного утолщения.
В это же время происходит перенос молекул ферментов и глутамата путем медленного транспорта.
(2) Мембранные белки пузырьков выходят из плазматической мембраны и формируют синаптические пузырьки.
(3) Глутамат погружается в синаптические пузырьки; происходит накопление медиатора.
(4) Пузырьки, содержащие глутамат, подходят к пресинаптической мембране.
(5) В результате деполяризации происходит экзоцитоз медиатора из частично разрушенных пузырьков.
(6) Высвобождающийся медиатор распространяется диффузно в области синаптической щели и активирует специфические рецепторы на постсинаптической мембране.
(7) Мембраны синаптических пузырьков транспортируются обратно в клетку путем эндоцитоза.
(8) Происходит частичный обратный захват глутамата в клетку для повторного использования.
(Б) Передача нейропептидов (например, субстанции Р), осуществляющаяся одновременно с синаптической передачей (например, глутамата).
Совместная передача этих веществ происходит в центральных нервных окончаниях униполярных нейронов, обеспечивающих болевую чувствительность.
(1) Синтезированные в комплексе Гольджи (в области перикариона) пузырьки и предшественники пептидов (пропептиды) транспортируются к булавовидному расширению путем быстрого транспорта.
(2) При их попадании в область булавовидного утолщения завершается процесс формирования молекулы пептида, и пузырьки транспортируются к плазматической мембране.
(3) Деполяризация мембраны и перенос содержимого пузырьков в межклеточное пространство путем экзоцитоза.
(4) Одновременно с этим происходит высвобождение глутамата.
1. Активация рецепторов. Молекулы медиаторов проходят через синаптическую щель и активируют рецепторные белки, расположенные парами на постсинаптической мембране. Активация рецепторов запускает ионные процессы, которые приводят к деполяризации постсинаптической мембраны (возбуждающее постсинаптическое действие) или гиперполяризации постсинаптической мембраны (тормозящее постсинаптическое действие). Изменение электротонуса передается в сому в виде затухающего по мере распространения электротонического потенциала, за счет которого происходит изменение потенциала покоя в начальном сегменте аксона.
Ионные процессы подробно описаны в отдельной статье на сайте. При преобладании возбуждающих постсинаптических потенциалов начальный сегмент аксона деполяризуется до порогового уровня и генерирует потенциал действия.
Наиболее распространенный возбуждающий медиатор ЦНС — глутамат, а тормозной — гамма-аминомасляная кислота (ГАМК). В периферической нервной системе медиатором для двигательных нейронов поперечно-полосатой мускулатуры служит ацетилхолин, а для чувствительных нейронов — глутамат.
Последовательность процессов, происходящих в глутаматергических синапсах, показана на рисунке ниже. При передаче глутамата совместно с другими пептидами высвобождение пептидов осуществляется внесинаптическим путем.
Большинство чувствительных нейронов помимо глутамата выделяет и другие пептиды (один или несколько), высвобождающиеся в различных участках нейрона; однако основная функция этих пептидов — модуляция (повышение или снижение) эффективности синаптической передачи глутамата.
Кроме того, нейротрансмиссия может происходить путем диффузной внесинаптической передачи сигнала, характерной для моноаминергических нейронов (нейронов, использующих биогенные амины для обеспечения нейротрансмиссии). Выделяют две разновидности моноаминергических нейронов. В одних нейронах осуществляется синтез катехоламинов (норадреналина или дофамина) из аминокислоты тирозина, а в других — серотонина из аминокислоты триптофана. Например, дофамин высвобождается как в синаптической области, так и из варикозных утолщений аксона, в которых также происходит синтез этого нейромедиатора.
Дофамин проникает в межклеточную жидкость ЦНС и до момента деградации способен активировать специфические рецепторы на расстоянии до 100 мкм. Моноаминергические нейроны присутствуют во многих структурах ЦНС; нарушение передачи импульса этими нейронами приводит к различным заболеваниям, среди которых выделяют болезнь Паркинсона, шизофрению и глубокую депрессию.
Оксид азота (газообразная молекула) также участвует в диффузной нейропередаче в глутаматергической системе нейронов. Избыточное влияние оксида азота оказывает цитотоксическое действие, особенно в тех участках, кровоснабжение которых нарушено за счет тромбоза артерий. Глутамат также является потенциально цитотоксическим нейромедиатором.
В отличие от диффузной нейротрансмиссии, традиционную синаптическую передачу сигнала ввиду ее относительной стабильности называют «проводниковой».
в) Резюме. Мультиполярные нейроны ЦНС состоят из сомы, дендритов и аксона; аксон образует коллатеральные и терминальные ветви. В соме расположены гладкая и шероховатая эндоплазматическая сети, комплексы Гольджи, нейрофиламенты и микротрубочки. Микротрубочки пронизывают нейрон на всем протяжении, принимают участие в процессе антероградного транспорта синаптических пузырьков, митохондрий и веществ для построения мембран, а также обеспечивают ретроградный транспорт «маркерных» молекул и разрушенных органелл.
Существует три вида химических межнейрональных взаимодействий: синаптическое (например, глутаматергическое), внесинаптическое (пептидергическое) и диффузное (например, моноаминергическое, серотонинергическое).
Химические синапсы классифицируют по анатомическому строению на аксодендритические, аксосоматические, аксоаксональные и дендро-дендритические. Синапс представлен пре- и постсинаптическими мембранами, синаптической щелью и субсинаптической активной зоной.
Электрические синапсы обеспечивают одновременную активацию целых групп нейронов, образуя между ними электрические связи за счет щелевидных контактов (нексусов).
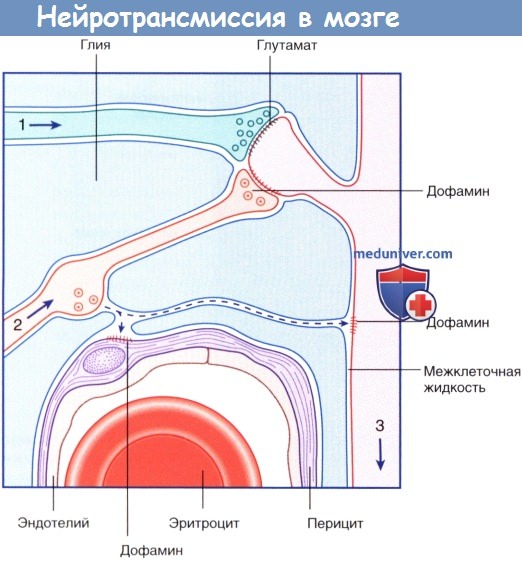
Аксоны глутаматергического (1) и дофаминергического (2) нейронов образуют плотные синаптические контакты с отростком звездчатого нейрона (3) полосатого тела.
Дофамин высвобождается не только из пресинаптической области, но и из варикозного утолщения аксона, откуда диффузно распространяется в межклеточное пространство и активирует дофаминовые рецепторы дендритного ствола и стенки перицита капилляра. 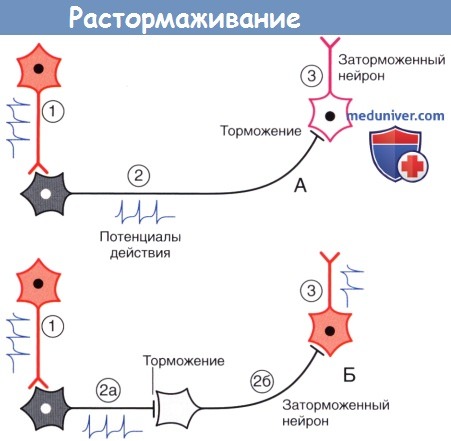
(А) Возбуждающий нейрон 1 активирует тормозной нейрон 2, который в свою очередь затормаживает нейрон 3.
(Б) Появление второго тормозного нейрона (2б) оказывает противоположное влияние на нейрон 3, поскольку происходит торможение нейрона 2б.
Спонтанно-активный нейрон 3 генерирует сигналы в условиях отсутствия тормозных влияний.
3. Торможение и растормаживание. Функционирование спонтанно-активных нейронов сдерживается под влиянием тормозных нейронов (обычно, ГАМКергических). Деятельность тормозных нейронов, в свою очередь, может быть ингибирована воздействующими на них другими тормозными нейронами, в результате чего происходит растормаживание клетки-мишени. Процесс растормаживания — важная особенность нейрональной активности в базальных ганглиях.
4. Редкие виды химических синапсов. Выделяют два типа аксоаксональных синапсов. В обоих случаях булавовидное утолщение образует тормозной нейрон. Синапсы первого типа образуются в области начального сегмента аксона и передают мощное ингибирующее влияние тормозного нейрона. Синапсы второго типа образуются между булавовидным утолщением тормозного нейрона и булавовидными утолщениями возбуждающих нейронов, что приводит к угнетению высвобождения медиаторов. Этот процесс получил название пресинаптического торможения. В этом плане традиционный синапс обеспечивает постсинаптичсекое торможение.
Дендро-дендритические (Д-Д) синапсы образуются между дендритными шипиками дендритов смежных шипиковых нейронов. Их задача — не генерирование нервного импульса, а изменение электротонуса клетки-мишени. В последовательных Д-Д-синапсах синаптические пузырьки располагаются только в одном дендритном шипике, а в реципрокном Д-Д-синапсе— в обоих. Возбуждающие Д-Д-синапсы изображены на рисунке ниже. Тормозные Д-Д-синапсы широко представлены в переключающих ядрах таламуса.
Кроме того, выделяют немногочисленные сомато-дендритические и сомато-соматические синапсы.
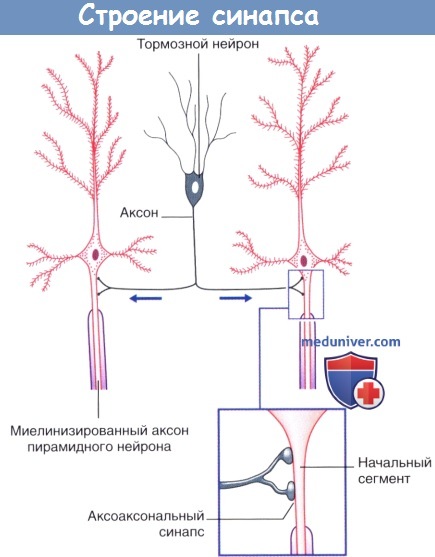
Стрелками указано направление проведения импульсов. 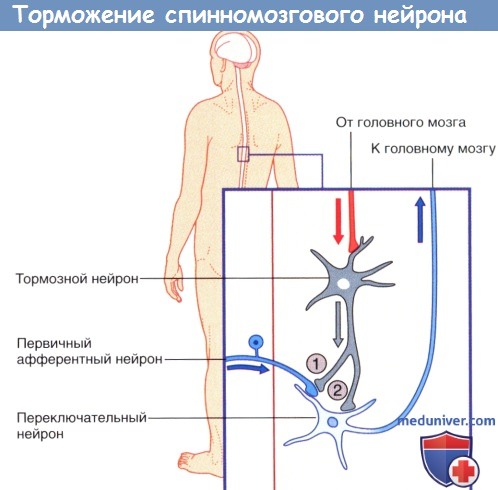
Стрелками указано направление проведения импульсов (возможно торможение переключательного нейрона под действием тормозных влияний). 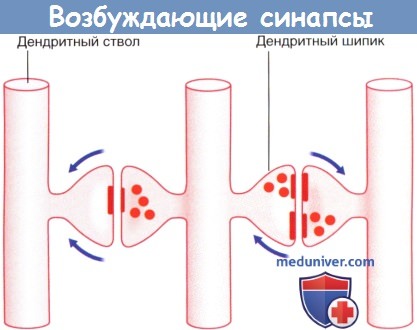
Реципрокный синапс (справа). Стрелками указано направление распространения электрото-нических волн.
Редактор: Искандер Милевски. Дата публикации: 11.11.2018
В полном объеме: синаптические везикулы в трехмерной модели синапса
Тонкое строение синаптических везикул является ключом к пониманию работы внутриклеточного мембранного транспорта
Автор
Редакторы
Синаптические везикулы обеспечивают связь между нейронами, а значит, их изучение является необходимым для понимания того, как функционирует нервная система. Кроме того, везикулы являются моделью для изучения общих для всех клеток механизмов клеточного транспорта. Новая трехмерная модель синапса включает 300 тысяч белков в атомарном разрешении. Эта подробная модель открывает новые возможности для изучения тонких механизмом работы синаптических везикул.
По приблизительным оценкам, в среднем в эукариотической клетке содержится 7,9×10 9 молекул белков [1]. Удивительно, но такое огромное число молекул не ведет к хаосу и неразберихе, а обеспечивает точное выполнение всех клеточных функций, в которых у каждой молекулы есть свои место и задача. Благодаря подробному изучению различных клеточных процессов и молекулярных путей, ученые проникают все глубже в понимание тонкой клеточной организации. Важное место в таких исследованиях занимает исследование работы синаптических пузырьков (везикул), ведь они не только являются основой функционирования нашей нервной системы, но и представляют собой модель для изучения общих принципов мембранного транспорта. Не даром в 2013 году за исследования везикулярного транспорта вручена Нобелевская премия по физиологии и медицине [2]!
Синаптические везикулы — это маленькие мембранные пузырьки, находящиеся в синаптических окончаниях нейронов (особые расширения на концах нейронных отростков, обеспечивающие связь между нейронами). Синаптические везикулы заполнены медиаторами — химическими веществами, которые изменяю работу нейронов. Когда везикулы сливаются с мембраной синаптического окончания, медиатор попадает в щель между синаптическими окончаниями двух нейронов и таким образом передает сигнал от одного нейрона к другому. Благодаря тому, что все синаптические везикулы сконцентрированы в синаптических окончаниях, их легко выделять из изучаемых тканей для анализа. Поэтому именно судьба синаптических везикул — это один из самых хорошо изученных сейчас клеточных путей.
Известно, что он состоит из трех этапов. Сначала пузырек прикрепляется к специальному участку синаптической мембраны — активной зоне (этот этап называется докинг). Потом он подготавливается к слиянию с синаптической мембраной (прайминг) и, в конце концов, сливается с ней, высвобождая медиатор в синаптическую щель (экзоцитоз). Параллельно на синаптической мембране происходит эндоцитоз с образованием пузырька, который постепенно обеспечивается всеми необходимыми молекулами и медиатором для восполнения запаса везикул.
Для того, чтобы более полно описать работу синаптической везикулы и синаптичсекого окончания, необходимо подробно изучить ее молекулярное строение и белковый состав. Первая модель синаптического пузырька с атомным разрешением появилась еще семь лет назад [3]. В этой работе ученым удалось изучить некоторые особенности устройства везикулы, — например, они обнаружили, что белковые молекулы занимают около 20% поверхности мембраны везикулы, и при этом липидные компоненты мембраны представлены, по больше части, «жесткими» малоподвижными липидами. Новая работа ученых из Гёттингена позволила дополнить эти данные и подробно охарактеризовать соотношение различных белковых молекул внутри синаптического пузырька [4].
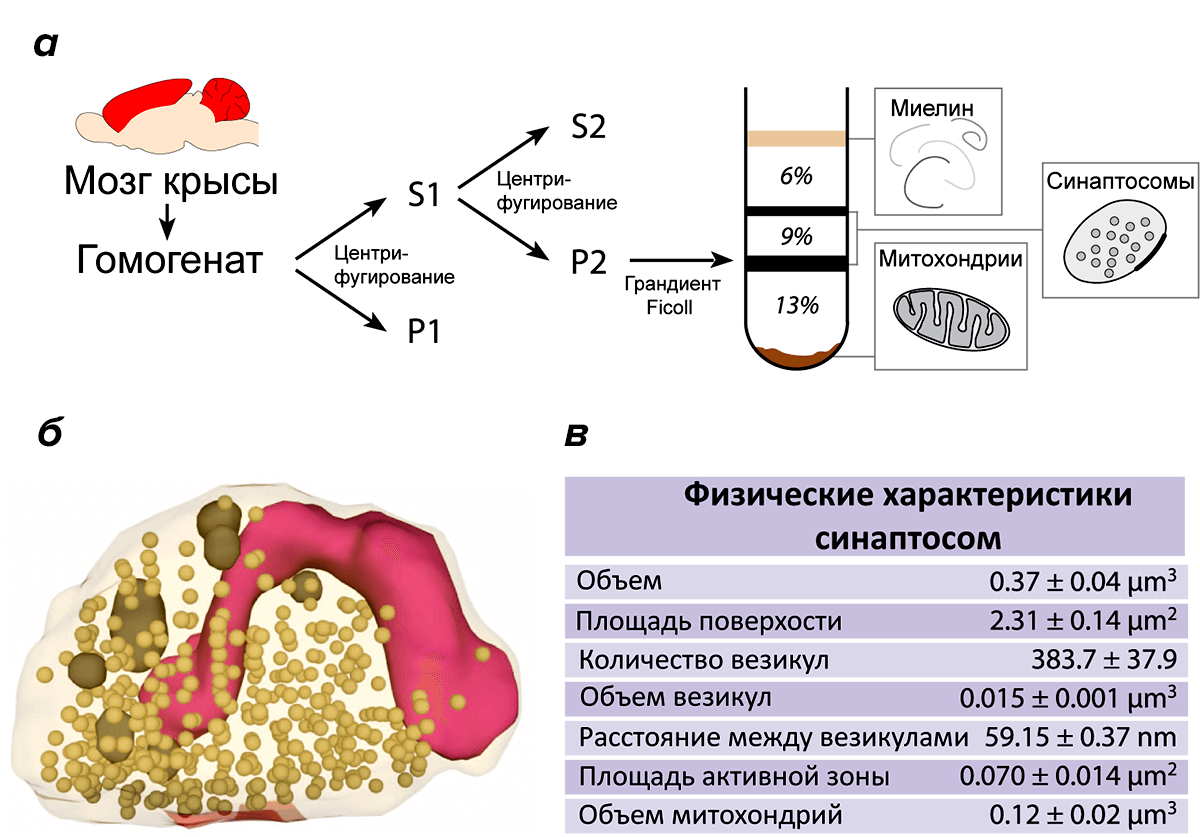
Группа исследователей под руководством Силвио Риццоли использовала комплексный подход, объединив количественный иммуноблоттинг, масс-спектрометрию, электронную микроскопию и флуоресцентную микроскопию высокого разрешения, что позволило им охарактеризовать не только количество разных белков в везикулах и в цитоплазме вокруг них, но и их расположение внутри синаптического окончания. На первом этапе своего исследования они выделили синаптические окончания из образцов мозга крысы. Сделать это можно с помощью центрифугирования в градиенте полисахарида (в данной работе был использован синтетический полисахарид Ficoll, но подобный эксперимент можно провести и с обыкновенной сахарозой).
Разные компоненты клетки имеют разную плотность, поэтому, если разрушенные клетки (гомогенат) поместить в пробирку с несколькими слоями растворов сахара разной концентрацией и начать вращать на центрифуге, органеллы распределяться по этим слоям, выбирая слой с близкой плотностью. При разрушении нервных клеток синаптические окончания отрываются от нейронных отростков и образуют так называемые синаптосомы, которые можно обнаружить в слое с 9% концентрацией полисахарида Ficoll (рис. 1). Полученный образец синаптосом исследователи, прежде всего, изучили с помощью электронного микроскопа. Это помогло охарактеризовать пространственные параметры синаптосом: их размер, количество синаптических пузырьков в одной синаптосоме, объем этих пузырьков.
Рисунок 1. Синаптосомы. а — Схема приготовление препарата синаптосом. б — Реконструкция синаптосомы по электронным микрофотографиям. Красным отмечена активная зона, темно-бежевым — синаптические везикулы, темно-серым — более крупные органеллы, розовым — митохондрия.
Убедившись, что процедура выделения синаптосом не изменила содержащееся в них количество белков, ученые вычислили концентрацию 62 различных белков с помощью количественного иммуноблоттинга. Суть этого метода заключается в сравнении количества каждого из белков в экспериментальном образце и в контрольных образцах с заранее известной концентрацией белка. Полученные результаты хорошо согласовывались с более ранними исследованиями. Отклонение было обнаружено только для белка SV2 (synaptic vesicle 2): в данном исследовании его количество было оценено как 12 копий на один синаптический пузырек, тогда как в других исследованиях — 1,7 и 5 копий.
Метод иммуноблоттинга основан на работе антител, которые распознают только целые белки, содержащие определенную последовательность аминокислот. При этом, если часть белков при приготовлении экспериментального образца (гомогената клеток) была разрушена и/или утратила необходимую аминокислотную последовательность, эта фракция белков не будет распознана. Именно поэтому иммуноблоттинг помог исследовать только около 40,5% общего содержания белков в синаптосомах. Для того, чтобы сделать оценку количества белков более точной, исследователи обратились к количественной масс-спектрометрии — к методу iBAQ (intensity-based absolute quantification, основанный на интенсивности полный подсчет). iBAQ вычисляет количество того или иного белка, учитывая все пептиды, которые могли появиться при его разрушении. Использование этого метода помогло увеличить долю проанализированных белков до 88,4%, при этом результаты хорошо коррелировали с данными, полученными при иммуноблоттинге.
Рисунок 2. Белковый состав пресинаптического окончания на примере синаптическо-го белка VAMP2. На рисунках в первом столбце изображены схемы препаратов, AZ — активная зона, ves — везикулы. Во втором и третьем столбцах — иммуногистохимическая окраска на белки VAMP2, маркер активной зоны (Bassoon или Bungarotoxin) и маркер синаптических пузырьков (Synaptophysin). В столбцах 4–6 — распределение белков VAMP2, Amphiphysin, Syntaxin 16 в синапсе. Более яркая окраска показывает большее количество белка интереса в данном участке синаптосомы.
Внутренним контролем служило то, что белки, образующие различные белковые комплексы (например, структурные белки везикулярных кластеров или белки активной зоны) были обнаружены в правильных соотношениях. Интересным и неожиданным открытием оказалось то, что количество белков, задействованных на разных этапах везикулярного цикла, разительно отличается. Количество белков комплекса SNARE (необходимого для слияния синаптического пузырька с синаптической мембраной) составляло 20–26 тысяч копий в одной синаптосоме, хотя для экзоцитоза одной везикулы достаточно 1–3 копий этого комплекса. При этом в одной синаптосоме всего около 4 тысяч молекул клатрина и около 2,3 тысяч молекул динамина. Для работы одного синаптического пузырька нужно 150–180 копий клатрина, а значит, всего клатрина, который присутствует в одном синапсе, хватит для экзоцитоза только 7% везикул этого синапса. Аналогичные расчеты для динамина показывают, что его количество достаточно для экзоцитоза всего 11% везикул. При этом количество белков, необходимых для эндоцитоза везикул (для замешения использованных пузырьков), было еще ниже — от 50 до 150 копий.
Для того, чтобы объяснить эти неожиданные результаты, ученые предположили, что для некоторых белков их точное расположение в месте использования может компенсировать недостаточное количество копий. В то же время, белки, количество которых оказалось удивительно большим, могут располагаться в синапсе очень рассеянно, поэтому в каждом конкретном месте синапса их концентрация будет низкой. Проверить эти предположения исследователям помогло использование флуоресцентной микроскопии высокого разрешения — метода STED-микроскопии [5] (Stimulated Emission Depletion Microscopy, микроскопия на основе подавления спонтанного испускания). В качестве контрольных образцов ученые использовали культуру нейронов гиппокампа и нервно-мышечное окончание взрослых крыс.
С помощью флуоресцентной микроскопии было изучено расположение 62 различных белков относительно активной зоны синапса и везикулярного кластера (скопления везикул в синаптическом окончании). Оказалось, что большинство белков распределено в объеме синапса более-менее равномерно (учитывая, что большинство белков активной зоны находится в активной зоне, а везикулярный кластер занимает почти весь объем синаптосомы). Таким образом, компенсация за счет особенностей распределения для белков синапса не характерна, а значит, вопрос о том, почему количество копий одних белков значительно больше количества копий других, остается открытым.
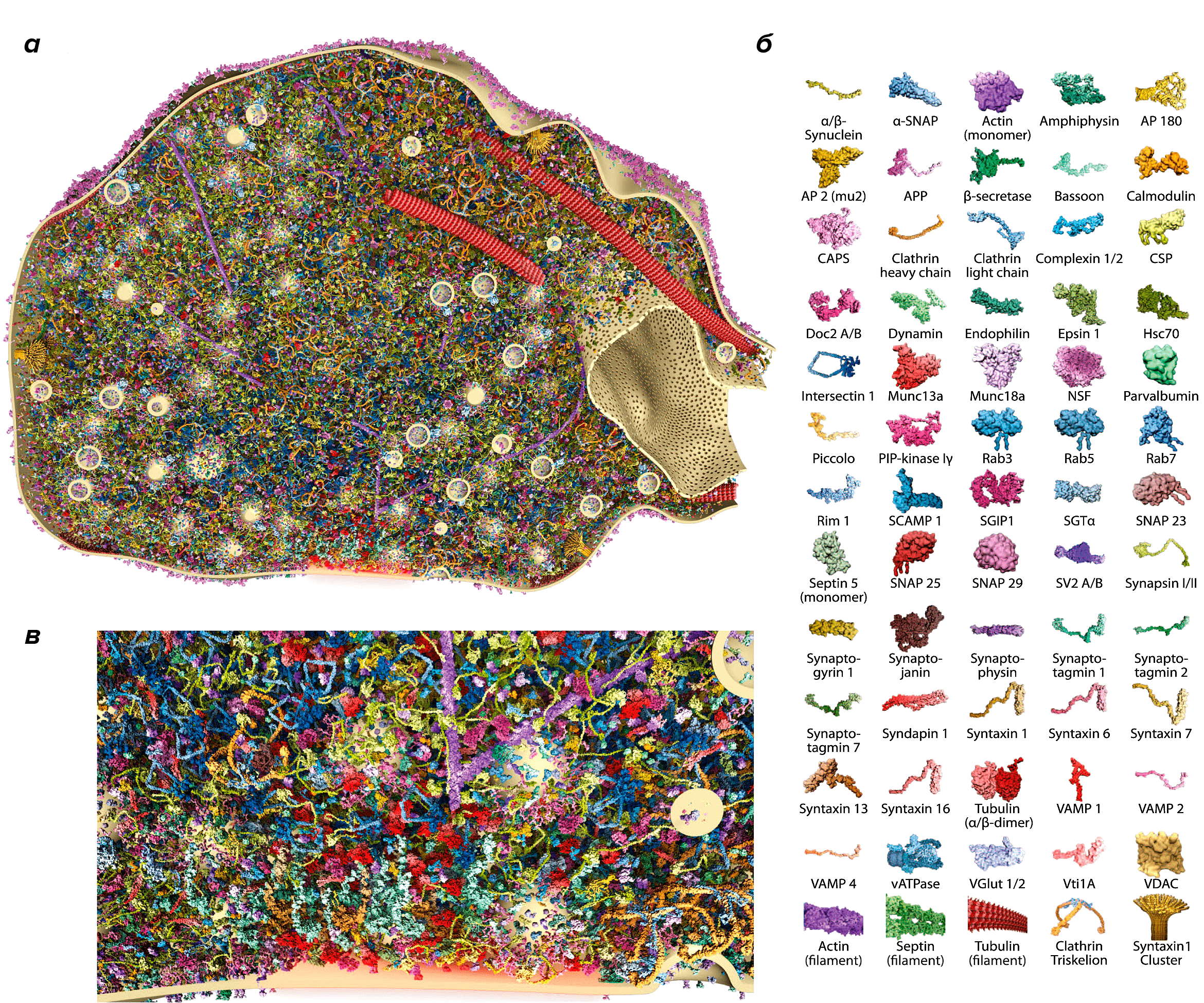
Полученные с помощью STED-микроскопии данные помогли исследователям построить трехмерную реконструкцию синаптического окончания, содержащую 60 различных белков (рис. 3). Все белки были смоделированы с атомарной точностью и расположены в характерных участках синапса, в соответствии с полученными экспериментальными результатами и литературными данными. Эта модель демонстрирует, что синаптическое окончание достаточно плотно заполнено везикулами, что, вероятно, препятствует свободному перемещению молекул и органелл. Возможно, что большое количество копий некоторых белков является эволюционным приспособлением к этой особенности строения синаптического окончания, помогающим обеспечить быстрое высвобождение медиатора в синаптическую щель. При этом образование новых везикул взамен использованных (эндоцитоз) может проходить гораздо медленнее без вреда для функционирования синапса. Это может объяснить небольшое количество копий эндоцитозных белков. При этом для того чтобы обеспечить нормальную работу синаптического окончания, нужно иметь большой запас готовых везикул, что и показывают результаты трехмерной реконструкции.
Рисунок 3. Трехмерная реконструкция синапса. а — Срез через синаптическое окончание. Изображение содержит 60 белков, которые расположены в количестве копий и местоположениях, определенных с помощью микроскопии. б — Белки, указанные на реконструкции синапса. в — Увеличенное изображение активной зоны.
Полученные немецкими учеными результаты позволяют более подробно описать функционирование синаптического окончания и работу системы везикулярного транспорта. Стало понятно, что в условиях высокой плотности везикул, количество и расположение белков в синаптическом окончании должно строго контролироваться. Но на вопрос о том, каким образом контролируется количество копий каждого из белков, предстоит ответить новым исследованиям. Осуществляется ли этот контроль на уровне транскрипции, трансляции или транспорта этих белков от тела нейрона к синаптическому окончанию? Возможно, что важную роль в этом контроле играют сами синаптические везикулы, которые могут связывать свободные белки и, таким образом, снижать их концентрацию в цитоплазме. Более подробно предстоит изучить и особенности регуляции трансмембранных белков синаптических пузырьков, которым было уделено немного внимания в описанной работе.
За последние два десятилетия компьютерные технологии начали вносить значительный вклад во все естественные науки, в том числе и в биологию. Наряду с масштабным анализом больших объемов данных и компьютерным моделированием различных биологических процессов, все большие обороты набирает научная визуализация, которая является областью компьютерной графики. Если на ранних этапах развития этой области ученым удавалось создавать только трехмерные модели белков и некоторых других молекул, то сейчас вычислительные мощности позволяют моделировать сравнительно крупные объекты — большие молекулярные комплексы и целые вирусы.
Отличным примером результатов научной визуализации могут послужить работы российской компании Visual Science в их проекте «Зоопарк вирусов» — самые подробные на данный момент научно достоверные модели ВИЧ и вируса гриппа. Специалисты Visual Science объединяют данные огромного количества работ по молекулярной биологии, вирусологии и кристаллографии, мнения экспертов ведущих научных центров мира и результаты молекулярного моделирования, полученные научным отделом компании.
О другом примере детальной научной визуализации было рассказано в этой статье. Уже сейчас можно утверждать, что такие подробные трехмерные модели помогают ученым получить более общий взгляд на изучаемый объект, обнаружить новые закономерности в его строении и функционировании. Несомненно, что в ближайшем будущем область применения научной визуализации будет расширяться, помогая исследователям совершать новые открытия.