Что находится между частицами
Кристаллическая решетка
Статья находится на проверке у методистов Skysmart.
Если вы заметили ошибку, сообщите об этом в онлайн-чат (в правом нижнем углу экрана).
Что такое кристаллическая решетка
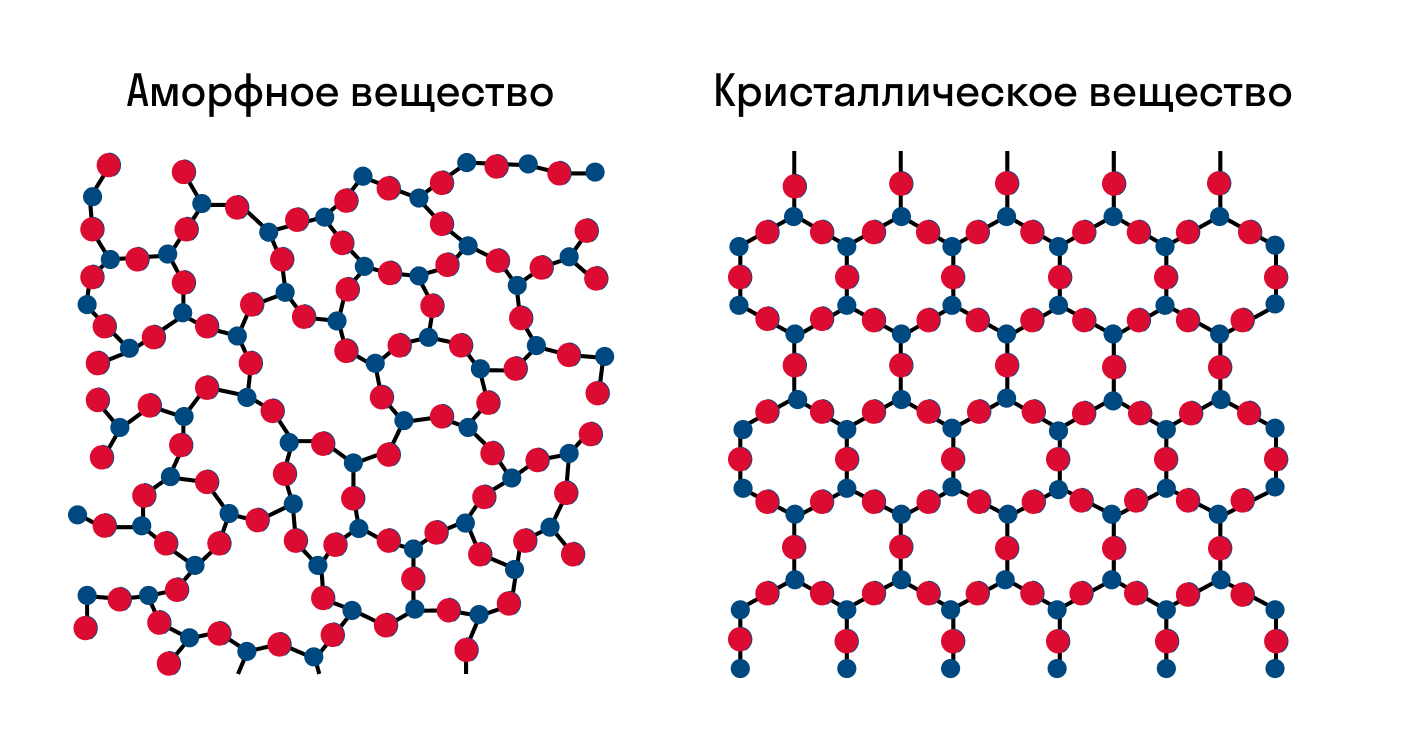
Как известно, все вещества состоят из частиц — атомов, которые могут располагаться хаотично или в определенном порядке. У аморфных веществ частицы расположены беспорядочно, а у кристаллических они образуют определенную структуру. Эта структура называется кристаллической решеткой. Она определяет такие характеристики вещества, как твердость, хрупкость, температура кипения и/или плавления, пластичность, растворимость, электропроводность и т. д.
Кристаллическая решетка — это внутренняя структура кристалла, порядок взаимного расположения атомов, ионов или молекул. Точки, в которых находятся эти частицы, называются узлами решетки.
Частицы удерживаются на своих местах благодаря химическим связям между ними. В зависимости от того, какой вид связи удерживает атомы или ионы данного вещества, в химии выделяют основные типы кристаллических решеток:
атомная (ковалентные связи),
молекулярная (ковалентные связи и притяжение между молекулами),
металлическая (металлические связи),
ионная (ионные связи).
Строение и агрегатное состояние веществ
Выделяют три агрегатных состояния: твердое тело, жидкость и газ. Каждое из них предполагает определенное расположение частиц. Ниже мы расскажем подробнее, как связаны в химии кристаллическая решетка и агрегатное состояние вещества, а пока осветим общие закономерности.
Если частицы хаотично движутся, а расстояние между ними многократно превышает их собственные размеры — это газ. За счет большой удаленности друг от друга молекулы и атомы в таком веществе слабо взаимодействуют между собой.
Если частицы расположены все так же беспорядочно, но на небольшом расстоянии друг от друга — это жидкость. В жидком состоянии вещества его молекулы и атомы имеют более прочные связи, которые сложнее разорвать.
Если частицы собраны близко друг к другу и в определенном порядке — это твердое тело. В таком состоянии связи между ними наиболее прочны. Частицы могут двигаться только в пределах своего расположения и почти не перемещаются в пространстве.
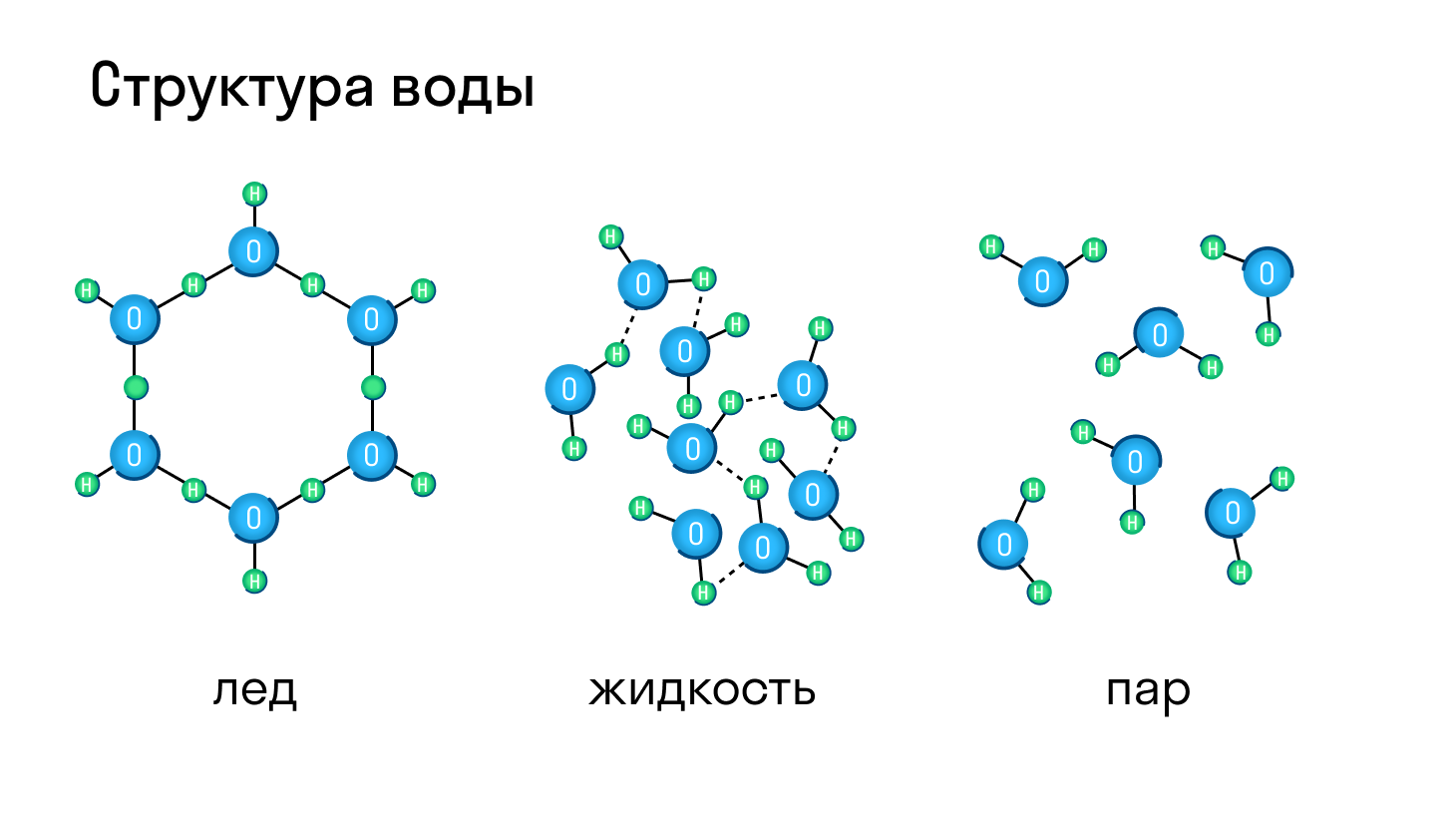
Большинство веществ могут находиться и в твердом, и в жидком, и газообразном состоянии, а в зависимости от давления и температуры легко переходить из одного в другое. Типичный пример — вода, которая при нагревании превращается в пар, а при остывании становится твердым льдом.
Атомная кристаллическая решетка
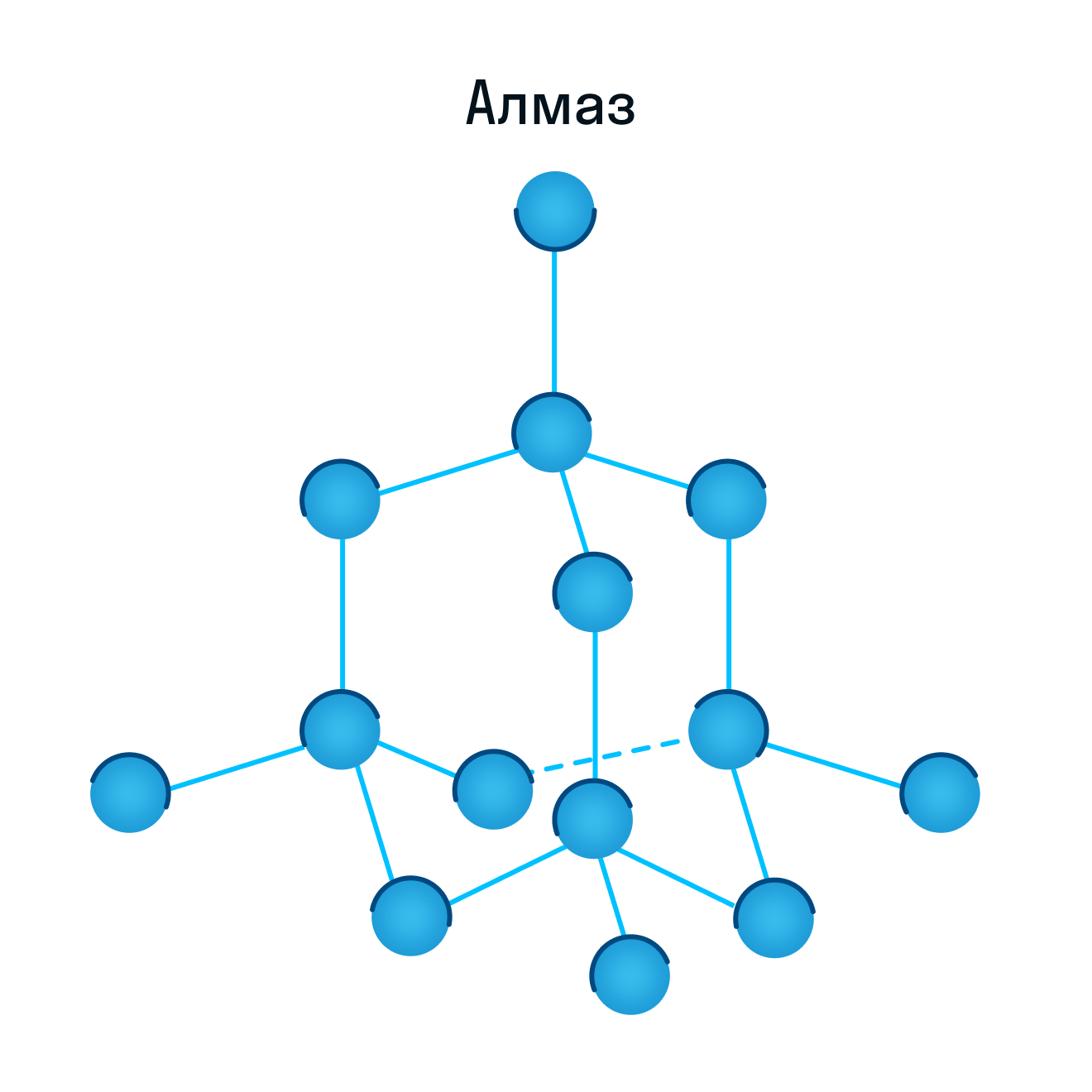
Согласно своему названию, атомная кристаллическая решетка — это структура, в узлах которой расположены атомы. Они взаимодействуют с помощью ковалентных связей, то есть один атом отдает другому свободный электрон или же электроны из разных атомов образуют общую пару. В кристаллах с атомной решеткой частицы прочно связаны, что обуславливает ряд физических характеристик.
Свойства веществ с атомной решеткой:
неспособность к растворению в воде,
высокая температура кипения и плавления.
К примеру, атомную кристаллическую решетку имеет алмаз — самый твердый минерал в мире.
Другие примеры: германий Ge, кремний Si, нитрид бора BN, карборунд SiC. Типичный представитель этой группы — обычный песок, который по сути является оксидом кремния SiO2.
Молекулярная кристаллическая решетка
Как и в предыдущей группе, в этой находятся вещества с ковалентными связями между атомами. Но физические характеристики этих веществ совершенно иные — они легко плавятся, превращаются в жидкость, растворяются в воде. Почему так происходит? Все дело в том, что здесь кристаллы строятся не из атомов, а из молекул.
Молекулярная кристаллическая решетка — это структура, в узлах которой находятся не атомы, а молекулы.
Внутри молекул атомы имеют прочные ковалентные связи, но сами молекулы связаны между собой слабо. Поэтому кристаллы таких веществ непрочные и легко распадаются.
Молекулярная кристаллическая решетка характерна для воды. При комнатной температуре это жидкость, но стоит нагреть ее до температуры кипения (которая сравнительно низка), как она тут же начинает превращаться в пар, т. е. переходит в газообразное состояние.
Некоторые молекулярные вещества — например, сухой лед CO2, способны преобразоваться в газ сразу из твердого состояния, минуя жидкое (данный процесс называется возгонкой).
Свойства молекулярных веществ:
у некоторых — наличие запаха.
Помимо воды к веществам с молекулярной кристаллической решеткой относятся аммиак NH3, гелий He, радон Rn, йод I, азот N2 и другие. Все благородные газы — молекулярные вещества. Также к этой группе принадлежит и большинство органических соединений (например, сахар).
Ионная кристаллическая решетка
Как известно, в ходе ионной химической связи один атом отдает другому ионы и приобретает положительный заряд, в то время как принимающий атом заряжается отрицательно. В итоге появляются разноименно заряженные ионы, из которых и состоит структура кристалла.
Ионная решетка — это кристаллическая структура, в узловых точках которой находятся ионы, связанные взаимным притяжением.
Ионную кристаллическую решетку имеют практически все соли, типичным представителем можно считать поваренную соль NaCl. О ней стоит вспомнить, если нужно перечислить физические характеристики этой группы. Также ионную решетку имеют щелочи и оксиды активных металлов.
Свойства веществ с ионной структурой:
способность растворяться в воде.
Примеры веществ с ионной кристаллической решеткой: оксид кальция CaO, оксид магния MgO, хлорид аммония NH4Cl, хлорид магния MgCl2, оксид лития Li2O и другие.
Металлическая кристаллическая решетка
Для начала вспомним, как проходит металлическая химическая связь. В молекуле металла свободные отрицательно заряженные электроны перемещаются от одного иона к другому и соединяются с некоторыми из них, а после отрываются и мигрируют дальше. В результате получается кристалл, в котором ионы превращаются в атомы и наоборот.
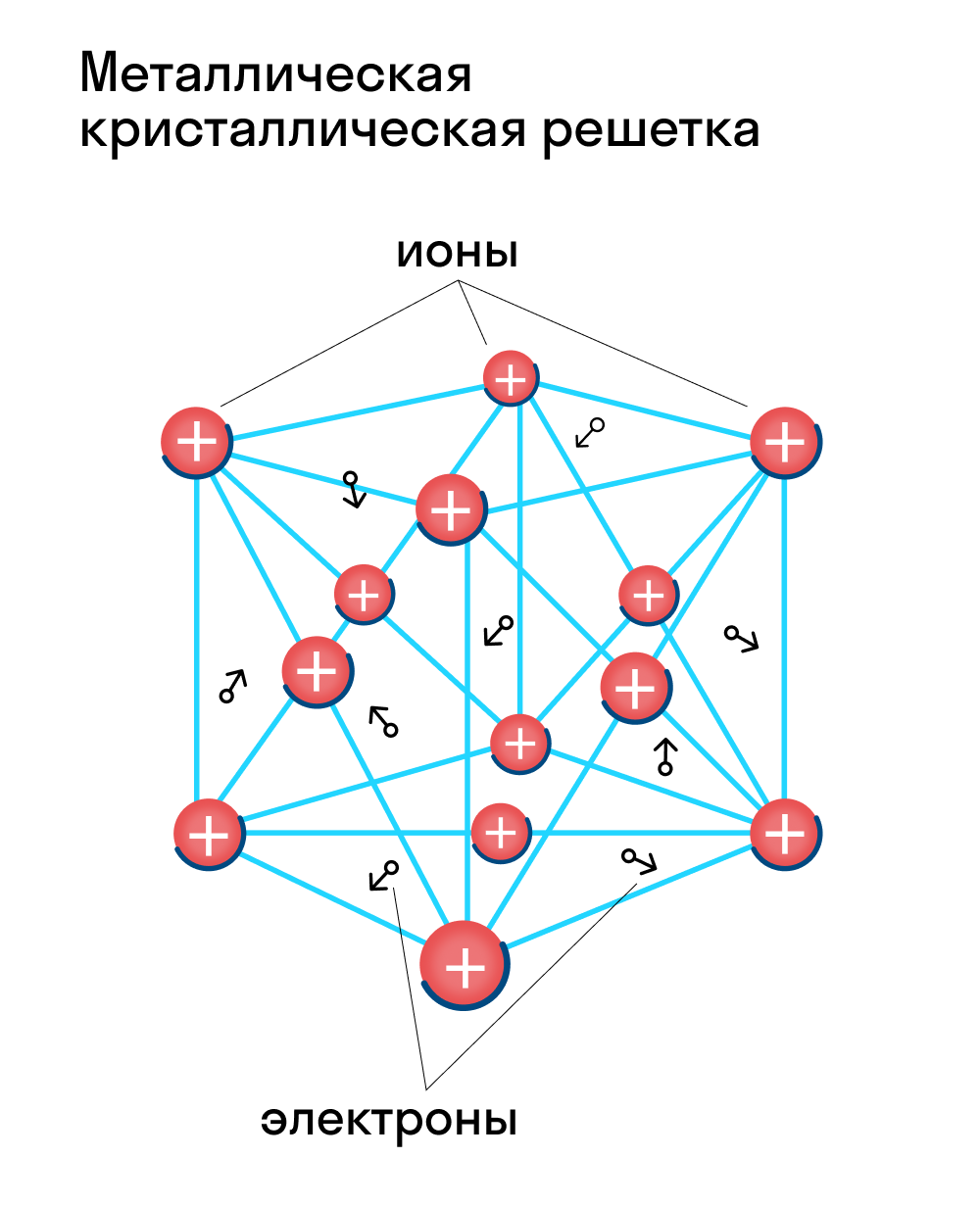
Металлическая кристаллическая решетка — это структура, которая состоит из ионов и атомов металла, а между ними свободно передвигаются электроны. Как несложно догадаться, она характерна лишь для металлов и сплавов.
Свободные электроны, мигрирующие между узлами решетки, образуют электронное облако, которое под воздействием электротока приходит в направленное движение. Это объясняет такое свойство металлов, как электрическая проводимость.
В химии типичным примером вещества, которое имеет металлическую кристаллическую решетку, считается медь. Она очень ковкая, пластичная, имеет высокую тепло- и электропроводность. Впрочем, все металлы ярко демонстрируют эти характеристики, поэтому назвать физические свойства данной группы несложно.
Свойства веществ с металлической кристаллической решеткой:
При этом температура плавления веществ может существенно различаться. Например, у ртути это −38,9°С, а у бериллия целых +1287°С.
Подведем итог: о характеристиках разных типов кристаллических решеток расскажет таблица.
Частицы в узлах решетки
Тип связи между частицами
Физические свойства веществ
Как определить кристаллическую решетку
Как понятно из предыдущего материала, строение вещества, его состав и физические характеристики тесно связаны. Поэтому для определения вида кристаллической решетки можно руководствоваться теми данными, которые у нас есть. Как правило, известен состав вещества, а значит, мы можем сделать вывод о химических связях внутри его молекулы, что позволит в свою очередь предположить тип решетки.
Также можно провести быстрый анализ:
если это неметалл, который при комнатной температуре представляет собой твердое тело — скорее всего он имеет атомную решетку;
если в обычных условиях это жидкость или газ либо речь об органическом веществе — предполагаем молекулярную решетку;
если это соль либо щелочь — кристаллы имеют ионную решетку;
если это металл или сплав — решетка точно будет металлической.
Вопросы для самопроверки:
Назовите виды кристаллических решеток.
Чем отличается кристаллическая решетка от химической связи?
Назовите примеры веществ с металлической кристаллической решеткой, с ионной, атомной и молекулярной.
Выберите лишнее вещество: молекулярную кристаллическую решетку имеет вода, поваренная соль, аргон, криптон.
Какое строение вещества придает ему высокую электропроводность?
Какое строение кристалла может придать веществу способность к возгонке?
Пустоты не существует: что находится между атомами и внутри них с точки зрения современной физики
Квантовая механика против философской идеи абсолютной пустоты.
Все твёрдые и осязаемые тела состоят из вещества, собранного в атомах и молекулах, но между частицами есть пространство, в котором как будто бы ничего нет. Если следовать этой логике, то окажется, что и сами атомы состоят из пустоты.
Внутри атомов находятся электроны — точечные частицы, которые не имеют размеров, а ядро атома примерно в 10 тысяч раз меньше самого атома. Выходит, что любой атом почти целиком состоит из пустоты — почти всё вещество атома сосредоточено в его ядре. Ядро, в свою очередь, состоит из нейтронов и протонов, а они сложены из ещё более элементарных частей, которые называются кварками. И кварки тоже не имеют размеров — это просто точки.
Примерно так атом выглядит на самом деле — миниатюрное ядро в центре электронного облака, а между ними как будто бы ничего нет
Меня гнетут смутные сомнения..
Это про экономику и бюджет России?
Подобные рассуждения исходят из неверных допущений. На самом деле пустоты не существует — на уровне микромира (одной триллионной доли миллиметра) есть как минимум три явления, которые делают размышления о пустоте бессмысленными.
Вещество не имеет чётких границ и вообще состоит из волн
Поведение молекул, атомов и отдельных частиц вроде нейтронов и протонов описывает квантовая механика со своими законами. Одно из основных правил квантовой механики — принцип неопределённости Гейзенберга. В вольной трактовке он звучит так:
Нельзя с одинаковой точностью узнать местонахождение частицы и её скорость. Чем больше определена скорость частицы — тем более размыто её местоположение, и наоборот.
Это ограничение фундаментально, оно не зависит от качества измерительных приборов. Чтобы как можно точнее определить скорость частицы — нужно пронаблюдать за ней какое-то время. В таких условиях о местоположении частицы можно сказать лишь «ну, её можно обнаружить где-то в этой области».
Принцип неопределённости — следствие двойственной природы любых частиц вещества. Тот же электрон — одновременно и частица, и волна. Как всякая волна, он «размыт» в пространстве. Поэтому в атоме его изображают не точкой, а целым облаком. Там, где яркость облака ниже — электрон находится реже, но вероятность его нахождения там никогда не равна нулю.
«Расплывчатость» микрочастиц это не допущение, продиктованное несовершенством научного оборудования, а фундаментальное свойство материи. Электрон — точечная частица, но только когда его зафиксировали (измерили). Пока электрон не зафиксирован — он «расплывается» как волна. Электрон не летает точкой где-то в этой волне — он и есть волна с неопределёнными границами и размерами.
Когда атомы собраны в молекулы, их электронные облака могут пересекать и перекрывать друг друга. Так что невозможно с уверенностью говорить о том, что между атомами — абсолютно пустое пространство. Там всегда может оказаться электрон. Принцип неопределённости может «забрасывать» его даже в самые «неудобные» области, просто вероятность этого крайне мала.
Электронные облака атома водорода на разных уровнях энергии электрона
Существуют «фотографии» и даже целые «видеозаписи» атомов, где они выглядят как чётко очерченные шарики. Но это не настоящие изображения атомов как они есть, а всего лишь визуализации, построенные на собранных данных. На таких визуализациях местоположение и границы атомов всегда изображаются «в среднем». Иначе понятная картинка превратилась бы в расплывчатую кашу.
Чем масштабнее вещественное тело — тем определённее его границы и местоположение. Поэтому отдельная частица может «заполнить собой» целую комнату (и даже Вселенную, это не запрещено), а тела, которые состоят из огромного числа частиц (стулья, машины и дома), не расплываются и занимают вполне конечное и определённое место.
Впрочем, даже большие тела не избавлены от квантовой «расплывчатости», просто их волновая составляющая так сильно сокращается, что становится незаметной. Но её можно засечь высокоточным оборудованием. Так, в обсерватории LIGO с помощью лазеров учёные зафиксировали квантовое «дрожание» 40-килограммового зеркала — оно колебалось в пределах одной миллионной одной миллиардной миллиметра.
Виртуальные частицы — «клей» мироздания
Пусть электрон с ненулевой вероятностью может проявиться где угодно — всё-таки в атоме есть «тёмные» области, где вероятность нахождения электрона крайне мала. То есть, в этих областях большую часть времени нет никаких электронов, как и протонов, как и нейтронов. Значит, там абсолютно пусто?
И снова нет. Даже в самой «тёмной» области между ядром атома и его электроном есть нечто вполне материальное — «привязь», с помощью которой ядро удерживает электрон в атоме. Эта «привязь» — поток виртуальных фотонов, которые безостановочно снуют между ядром и электроном.
Виртуальные частицы так называются, потому что их нельзя зафиксировать напрямую. Они слишком быстро исчезают, распадаясь или превращаясь в другие частицы примерно за одну триллионную одной триллионной доли секунды. Расстояние, на которое они успевают переместиться, сравнимо с их «расплывчатостью» из-за принципа неопределённости. Это позволяет виртуальным частицам нарушать некоторые законы физики.
«Нормальные» частицы вроде реальных электронов и фотонов подчиняются базовым законам физики — их импульсы однозначно связаны с энергией, а энергию они не могут брать из ниоткуда. Но виртуальные частицы могут появляться сами по себе вопреки закону сохранения энергии, могут иметь отрицательную или мнимую массу. Всё это — полная бессмыслица с точки зрения физики. Тем не менее, есть масса признаков существования виртуальных частиц.
Эти «неправильные» частицы поистине вездесущи — они безостановочно рождаются и тут же исчезают во всех точках пространства: и между атомами, и внутри атомов, и даже внутри микрочастиц. Более того, они успевают «передать информацию» от одной реальной частицы к другой, если те находятся достаточно близко. Как в случае с электроном и протоном в ядре атома.
Схема строения протона — реальные кварки, виртуальные кварки и виртуальные глюоны. Численные масштабы не соблюдены
Агрегатные состояния веществ
1. Основные положения, при помощи которых объясняется различие строения веществ в твердом, жидком и газообразном состоянии
Дети назовите вещество которое находится в трех агрегатных состояниях. Верно это вода. Которая может находиться в жидком, твёрдом и газообразном состоянии. Вода это жидкое состояние, пар газообразное состояние и лёд — твёрдое состояние. Скажите а какие положения веществ отличают одно состояние от другого. Это расположение частиц, движение частиц и взаимодействие частиц.
2. Расположение частиц в твердом состоянии, жидком и газообразном
И так, рассмотрим отличие одного состояния веществ от другого. В твёрдом состоянии частицы располагаются в строгом порядке, образуя кристалл. Частицы не имеют строгого положения в жидком состоянии. В газообразном состоянии нет строгого порядка.
3. Движение частиц в твердом, жидком и газообразном состоянии
Частицы в твердых телах совершают колебательное движение. Подобно маятнику часов. В жидкостях молекулы совершают бестолковое движение. В газообразном состоянии частицы движутся хаотично, беспорядочно, с очень большой скоростью. Она равна скорости пули из ружья. Примеры: при 20 градусах по Цельсию скорость молекулы водорода — 2000 м/с, а кислорода 1600 м/с, азота 600 м/с.
4. Взаимодействие частиц в твердом, жидком и газообразном состоянии
В твёрдом состоянии частицы взаимодействуют очень сильно между собой. Так как между частицами промежутки меньше размера одной частицы. В жидком состоянии взаимодействие слабее. Между частицами промежутки увеличиваются и равны размеру одной частицы. В газообразном состоянии взаимодействие частиц самое слабое. В промежутках между частицами можно поместить до десяти таких частиц.
5. Форма и объем которую принимают вещества в твердом, жидком и газообразном состоянии
Но кроме трёх положений агрегатные состояния характеризуются объемом и формой. В твёрдом состоянии форма неизменная. Жидкость принимает форму сосуда. И газы принимают форму сосуда. Объём твердых тел неизменный. Для изменения объема твердого тела, необходимо приложить огромные усилия. Объем жидкости изменить нельзя. Пример: возьмем свинцовый шар и заполнили его водой. Запаяли шар. Стали ударять молотом по нему, пытаясь уменьшить объем. Шар лопнул. Вода вылилась. Возникают силы отталкивания. Которые не дают возможности уменьшить объем. А в газах занимает наибольший, предоставленный объем. Примеры: возьмем медные опилки и поместим в мензурку большого объема. Нальем азотной кислоты. Закроем мензурку наполовину. Образуется бурый дым, который заполняет половину мензурки. Передвинем крышку вверх, до полного объема. Бурый дым заполняет все пространство. Это доказывает, что газы занимают наибольший предоставленный объем.
Взаимодействие частиц вещества



Третье положение МКТ говорит о взаимодействии частиц вещества: атомы или молекулы взаимодействуют друг с другом силами притяжения и отталкивания, которые зависят от расстояний между частицами: при увеличении расстояний начинают преобладать силы притяжения, при уменьшении — силы отталкивания.
О справедливости третьего положения МКТ свидетельствуют силы упругости, возникающие при деформациях тел. При растяжении тела увеличиваются расстояния между его частицами, и начинают преобладать силы притяжения частиц друг к другу. При сжатии тела расстояния между частицами уменьшаются, и в результате преобладают силы отталкивания. В обоих случаях упругая сила направлена в сторону, противоположную деформации.
Другим подтверждением существования сил межмолекулярного взаимодействия служит наличие трёх агрегатных состояний вещества.
В газах молекулы удалены друг от друга на расстояния, значительно превышающие размеры самих молекул (в воздухе при нормальных условиях — примерно в 1000 раз). На таких расстояниях силы взаимодействия между молекулами практически отсутствуют, поэтому газы занимают весь предоставленный им объём и легко сжимаются.
В жидкостях промежутки между молекулами сравнимы с размерами молекул. Силы молекулярного притяжения весьма ощутимы и обеспечивают сохранение жидкостями объёма. Но для сохранения жидкостями ещё и формы эти силы недостаточно велики — жидкости, как и газы, принимают форму сосуда.
В твёрдых телах силы притяжения между частицами очень велики: твёрдые тела сохраняют не только объём, но и форму.
Переход вещества из одного агрегатного состояния в другое является результатом изменения величины сил взаимодействия между частицами вещества. Сами частицы остаются при этом неизменными.
В предыдущем разделе, посвящённом основным положениям МКТ, мы вкратце описали молекулярное строение газов, жидкостей и твёрдых тел. Остановимся на этом вопросе подробнее.
Газы
Газы — самый простой объект для изучения в молекулярно-кинетической теории. Почему? Дело в том, что средние расстояния между частицами газов намного превышают размеры самих частиц. В промежутках между соударениями частицы газа проходят расстояния, на несколько порядков превышающие собственные размеры (рис. 3).
Рис. 3. Частицы газа
Например, в воздухе при нормальных условиях длина свободного пробега молекулы составляет примерно 10 −5 см. Это на три порядка превышает средний размер молекулы (10 −8 см).
При таких больших расстояниях между частицами силы межмолекулярного взаимодействия оказываются весьма незначительными. Во многих ситуациях взаимодействием частиц газа на расстоянии можно пренебречь и учитывать лишь их соударения друг с другом. Вот почему изучать газы гораздо проще, чем жидкости или твёрдые тела.
Не испытывая сильного притяжения со стороны других частиц, любая частица газа обладает полной свободой передвижения и может оказаться в любом месте сосуда. Поэтому газы не имеют ни фиксированной формы, ни фиксированного объёма. Мы можем поместить данную порцию газа в какой угодно сосуд, и газ неизменно займёт весь предоставленный ему объём. В зависимости от объёма сосуда будут изменяться лишь средние расстояния между частицами газа.
Способность газов менять свой объём находит широчайшее применение в технике. Функционирование тепловых двигателей и многих других устройств основано в конечном счёте на том, что газ при расширении перемещает поршень и совершает работу.
Твёрдые тела
Если сравнивать с газами, то твёрдые тела являются их полной противоположностью. Ни о какой свободе передвижения частицы твёрдых тел даже «не помышляют».
В твёрдых телах частицы расположены весьма близко друг к другу: расстояния между частицами порядка размера самих частиц. Силы взаимодействия между частицами твёрдого тела очень велики; расположение частиц в пространстве обладает периодической повторяемостью и образует так называемую кристаллическую решётку.
Например, на рис. 4 представлена пространственная модель кристаллической решётки кремния
. Шарики — это атомы кремния, а трубки между шариками изображают силы взаимодействия между атомами.
Рис. 4. Пространственная модель кристаллической решётки
Атомы кремния, как видите, расположены в пространстве периодическим образом, причём каждый атом сцеплен с четырьмя другими атомами. На рис. 5 мы видим плоское изображение той же самой кристаллической решётки (вдобавок показаны электроны, находящиеся на внешних оболочках атомов кремния).
Рис. 5. Плоское изображение кристаллической решётки
Точки пространства, в которых находятся частицы твёрдого тела, называются узлами кристаллической решётки.
На самом деле частицы не покоятся в узлах кристаллической решётки, а совершают тепловое движение — колеблются относительно этих самых узлов. Таким образом, узел кристаллической решётки — это положение равновесия частицы, в небольшой окрестности которого частица постоянно находится. Чтобы покинуть область своего обитания (выскочить из узла), частице нужна очень большая энергия; произойти такое событие может лишь при чрезвычайно редком стечении обстоятельств. Имея столь жёсткую внутреннюю структуру, твёрдое тело сохраняет неизменными свою форму и свой объём.
Жидкости
По своим свойствам жидкости занимают промежуточное положение между газами и твёрдыми телами: жидкости сохраняют объём, но не форму. Мы можем говорить об одном литре воды, переливая её из сосуда в сосуд; но при этом вода принимает форму сосуда.
Как и в твёрдых телах, частицы жидкости упакованы весьма плотно и совершают колебания около некоторых положений равновесия. Попытка сжатия жидкости немедленно приводит к деформациям самих молекул и встречает мощное сопротивление: жидкости, в отличие от газов, практически не сжимаемы.
Однако, в отличие от твёрдых тел, частица жидкости не привязана навсегда к своему положению равновесия: спустя некоторое время она скачком меняет его на новое положение и колеблется в окружении новых частиц. Затем — новый скачок, новый период «осёдлой жизни», и так далее (рис. 6). Если частицы твёрдых тел можно сравнить с людьми, имеющими свой дом, то частицы жидкостей — это кочевники, постоянно меняющие места своих стоянок.
 |
Рис. 6. «Осёдло-кочевая жизнь» молекулы жидкости
На рисунке мы видим молекулу жидкости, время от времени меняющую место своего расположения. «Ореол», окружающий молекулу, изображает область осёдлой жизни, внутри которой молекула совершает тепловые колебания. Теоретические расчёты показывают, что за время осёдлой жизни молекула совершает несколько десятков-сотен колебаний внутри области осёдлой жизни.
Силы притяжения между частицами жидкости достаточно велики для того, чтобы объём сохранялся фиксированным. Но ограниченность времени осёдлой жизни частиц придаёт жидкостям текучесть: жидкости не сохраняют форму.
Рассмотрим для примера воду в стакане. Скачки молекул из одного осёдлого положения в другое происходят равновероятно по всем направлениям. Но если стакан наклонить, то в определённых участках воды сила тяжести задаст преимущественное направление этих скачков, и форма воды в стакане поменяется. Таково в общих чертах объяснение текучести.
Введём основные величины молекулярной физики и соотношения между ними.
m — масса вещества, V — объём вещества, 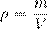
N — число частиц вещества (атомов или молекул). m0 — масса частицы вещества. Тогда
Что получится, если m0 умножить на n? Произведение массы частицы на число частиц в единице объёма даст массу единицы объёма, т.е. плотность. Формально:
Массы и размеры частиц невообразимо малы по нашим обычным меркам. Например, масса атома водорода порядка 10 −24 г, размер атома порядка 10 −8 см. Из-за столь малых значений масс и размеров число частиц в макроскопическом теле огромно.
Оперировать столь грандиозными числами, как число частиц, неудобно. Поэтому для измерения количества вещества используют специальную единицу — моль.
Один моль — это количество вещества, в котором содержится столько же атомов или молекул, сколько атомов содержится в 12 граммах углерода. А в 12 граммах углерода содержится примерно 6,02 · 10 23 атомов. Стало быть, в одном моле вещества содержится 6,02 · 10 23 частиц.
Количество вещества обозначается ν. Это число молей данного вещества.
Что получится, если ν умножить на NA? Число молей, умноженное на число частиц в моле, даст общее число частиц:
Масса одного моля вещества называется молярной массой этого вещества и обозначается µ ([µ] = кг/моль). Ясно, что
Как найти молярную массу химического элемента? Оказывается, для этого достаточно заглянуть в таблицу Менделеева! Нужно просто взять атомную массу A (число нуклонов) данного элемента — это будет его молярная масса, выраженная в г/моль. Например, для алюминия A = 27, поэтому молярная масса алюминия равна 27 г/моль или 0,027 кг/моль.
Почему так получается? Очень просто. Молярная масса углерода равна 12 г/моль по определению. В то же время ядро атома углерода содержит 12 нуклонов. Выходит, что каждый нуклон вносит в молярную массу 1 г/моль. Поэтому молярная масса химического элемента с атомной массой A оказывается равной A г/моль.
Молярная масса вещества, молекула которого состоит из нескольких атомов, получается простым суммированием молярных масс. Так, молярная масса углекислого газа CO2 равна 12 + 16 · 2 = 44 г/моль = 0,044 кг/моль.
Будьте внимательны с молярными массами некоторых газов! Так, молярная масса газообразного водорода равна 2 г/моль, поскольку его молекула состоит из двух атомов (H2). То же касается часто встречающихся в задачах азота и кислорода (N2, O2). Вместе с тем, наиболее частый персонаж задач — гелий (He) — является одноатомным газом и имеет молярную массу 4 г/моль, предписанную таблицей Менделеева.
Ещё раз предостережение: при расчётах не забывайте переводить молярную массу в кг/моль! Если ваш ответ отличается от правильного на три порядка, то вы наверняка сделали именно эту, очень распространённую ошибку 🙂
Что получится, если m0 умножить на NA? Масса частицы, умноженная на число частиц в моле, даст массу моля, т. е. молярную массу:
Какова масса 500 моль углекислого газа?