Что мы подразумеваем под видами химической связи
Химические связи
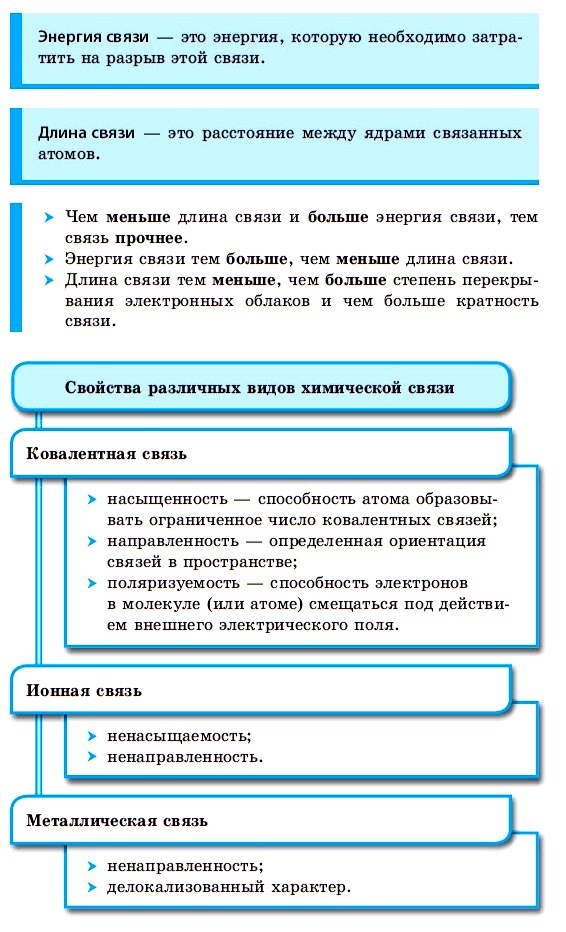
Различают несколько типов химических связей: ковалентная, ионная, металлическая, водородная.
Ковалентная связь возникает между двумя атомами по обменному механизму (обобществление пары электронов) или донорно-акцепторному механизму (электронов донора и свободной орбитали акцептора).
Ковалентной связью соединены атомы в молекулах простых веществ (Cl2, Br2, O2), органических веществ (C2H2), а также, в общем случае, между атомами неметалла и другого неметалла (NH3, H2O, HBr).
Существует донорно-акцепторный механизм образования ковалентной связи, при котором один атом выступает в качестве донора неподеленной электронной пары. Другой атом не тратит свои электроны, а только лишь предоставляет орбиталь (ячейку) для этой электронной пары.
Ионная связь
В наиболее частом случае ионная связь образуется между типичным металлом и типичным неметаллом. Примеры:
Большой подсказкой служит таблица растворимости, ведь все соли имеют ионные связи: CaSO4, Na3PO4. Даже ион аммония не исключение, между катионом аммония и различными анионами образуются ионные связи, например в соединениях: NH4I, NH4NO3, (NH4)2SO4.
Часто в химии встречаются несколько связей внутри одной молекулы. Рассмотрим, например, фосфат аммония, обозначив тип каждой связи внутри этой молекулы.
Металлическая связь
«Облако» электронов в металлах способно приходить в движение под различным воздействием. Именно оно является причиной электропроводности металлов.
Водородная связь
Водородные связи возникают между атомом водорода и другим более электроотрицательным атомом (O, S, N, C).
Отчасти за счет водородных связей наблюдается то самое исключение, связанное с усилением кислотных свойств в ряду галогеноводородных кислот: HF → HCl → HBr → HI. Фтор является самым ЭО-ым элементов, сильно притягивает к себе атом водорода другой молекулы, что снижает способность кислоты отщеплять водород и снижает ее силу.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Урок-семинар «Виды химической связи»
Разделы: Химия
Цель: обобщить и закрепить знания, полученные по теме: «Виды химической связи», подготовиться к контрольному тесту.
(Вопросы к семинарскому занятию раздаются учащимся на первом уроке темы: «Виды химической связи»).
Оборудование: таблицы: «Виды химической связи», «Электронное строение метана», «Электронное строение этилена», «Электронное строение ацетилена», «Типы кристаллических решеток», «Образование водородной связи между молекулами спиртов», «Образование водородной связи в молекуле белка», «Образование водородной связи в молекуле ДНК»; на столе у каждого ученика «Периодическая система Д.И. Менделеева».
I. Учитель знакомит учащихся с целью урока.
1. Что мы подразумеваем под видами химической связи?
2. Почему атомы соединяются в молекулы?
3. Из скольких атомов состоят молекулы инертных газов и почему?
4. Какие теории образования химической связи вам известны, кто и в каком году их выдвинул? (1916 г. Льюис (США), Коссель (Германия)).
5. Какие виды химической связи известны?
Обратите внимание на доску, здесь представлены все таблицы, которые помогали нам в изучении и освоении материала. Сейчас эти таблицы исчезнут, и вы без них самостоятельно будете выполнять задания, и покажете, насколько хорошо усвоена тема.
На доске написаны формулы веществ. Необходимо указать вид химической связи в каждом из них BCl3, H2S, K2O, H2, Al, NaI, CH4, CaBr2, F2, Fe. (Один из учеников вслух указывает виды связей в перечисленных формулах веществ.) А теперь подробно остановимся на каждом из перечисленных видов связей.
6. Дать определение ковалентной связи.
7. Назвать механизмы образования КС.
а) Способы перекрывания электронных облаков (σ и 
б) Механизм образования КС на примере F2
в) Механизм образования КС на примере H2S
г) Донорно-акцепторный механизм образования КС на примере NH4 +
9. Как классифицируется КС по степени смещения общей электронной пары? Определение КПС с примерами. Определение КНПС с примерами.
10. Свойства КС (длина, энергия, полярность, поляризуемость, насыщаемость, направленность).
Заслушиваются ответы ребят работающих у доски.
11. Американский ученый Полинг предложил теорию гибридизации электронных орбиталей. Что такое гибридизация, какие виды гибридизации вы знаете?
12. У доски: рассмотреть типы гибридизации электронных орбиталей в молекулах:
13. Дать определение ионной связи, привести примеры.
14. У доски: показать механизм образования ИС на примере K2O.
15. Свойства ИС (насыщаемость, направленность).
16. Металлическая связь (определение).
17. Свойства МС (насыщаемость, направленность).
18. Особенности строения веществ с МС, как они проявляются в свойствах.
Заслушиваются ответы ребят работающих у доски.
19. Определение водородной связи. (Межмолекулярная, внутримолекулярные) Как сказывается наличие водородной связи на свойствах веществ.
20. У доски: механизм образования ВС.
21. Могут ли различные типы связей содержаться в одних и тех же молекулах? Привести примеры.
22. Могут ли различные типы связей переходить одна в другую?
23. Что является причиной единства всех типов и видов химической связи.
24. В природе вещества встречаются в трех агрегатных состояниях. В каких? Для какого агрегатного состояния вещества справедлив термин «кристаллическая решетка»?
Заслушивается ответ ученика, который работал у доски.
25. Что называется кристаллической решеткой? Какие типы кристаллических решеток вы знаете?
У каждого ученика на столе лежит табличка: «Типы кристаллических решеток», которую надо заполнить.
26. У доски: Один из учеников заполняет графы аналогичной таблицы, предложенными вариантами ответов.
| Типы кристаллических решеток | Ионная | Молекулярная | Атомная | Металлическая |
| Частицы, находящиеся в узлах решетки | ||||
| Характер связи между частицами | ||||
| Прочность связи | ||||
| Физические свойства веществ | ||||
| Примеры |
1а) катионы и анионы
1г) атомы и катионы
2а) межмолекулярные силы притяжения и отталкивания, возможно образование водородных связей
2б) ионная связь (электростатическое притяжение)
2в) ковалентная неполярная или ковалентная полярная связи (образование общих электронных пар)
2г) металлическая связь (делокализация связывающих электронов)
3в) разная прочность
4а) металлический блеск, тепло- и электропроводность, пластичность, твердость различная, tпл, tкип различные
4б) очень высокие tпл, нерастворимость в воде, нелетучесть, твердость
4в) tпл, tкип низкие, хрупкость, летучесть, агрегатное состояние различное
4г) тугоплавкость, тепло- и электропроводность (проводники второго рода), агрегатное состояние при комнатной температуре твердое.
Хочется надеяться, что урок семинар поможет вам хорошо справиться с контрольными тестовыми заданиями по теме: «Виды химической связи»! Желаю удачи!
Химическая связь: определение, типы, свойства
Содержание:
Химическая связь, ее типы, свойства, наряду с химическими реакциями является одним из краеугольных камней интересной науки под названием химия. В этой статье мы разберем все аспекты химических связей, их значение в науке, приведем примеры и многое другое.
Определение
Под химической связью в химии понимается взаимное сцепление атомов в молекуле и кристаллической решетке, в результате действия силы притяжения, существующей между атомами. Именно благодаря химическим связям происходит образование различных химических соединений, в этом заключается природа химической связи.
Типы связей
Механизм образования химической связи сильно зависит от ее типа или вида, в целом различаются такие основные виды химической связи:
Что касается ковалентной химической связи, то на нашем сайте ей посвящена отдельная статья, и более детально вы можете почитать по ссылке. Далее же мы разберем более детально все другие основные типы химических связей.
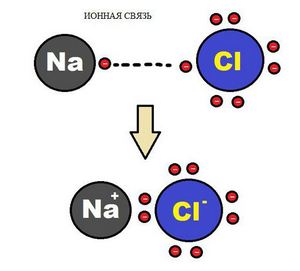
Ионная связь
Образование ионной химической связи возникает при взаимном электрическом притяжении двух ионов, имеющих разные заряды. Ионы обычно при таких химических связях простые, состоящие из одного атома вещества.
Схема ионной химической связи.
Характерной особенностью ионного типа химичечкой связи является отсутствие у нее насыщенности, и как результат, к иону или даже целой группе ионов может присоединиться самое разное количество противоположно заряженных ионов. Примером ионной химической связи может служить соединение фторида цезия CsF, в котором уровень «ионости» составляет практически 97%.
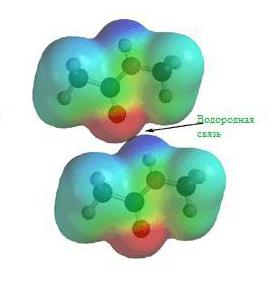
Водородная связь
Еще задолго до появления современной теории химических связей в ее современном виде учеными химиками было замечено, что соединения водорода с неметаллами обладают различными удивительными свойствами. Скажем, температура кипения воды и вместе со фтороводородом гораздо выше, чем это могло бы быть, вот вам готовый пример водородной химической связи.
На картинке схема образования водородной химической связи.
Природа и свойства водородной химической связи обусловлены способностью атома водорода H образовывать еще одну химическую связь, отсюда собственно и название этой связи. Причиной образования такой связи являются свойства электростатических сил. Например, общее электронное облако в молекуле фтороводорода настолько смещено в сторону фтора, что пространство вокруг атома этого вещества насыщено отрицательным электрическим полем. Вокруг атома водорода, тем более лишенного своего единственного электрона, все с точностью до наоборот, его электронное поле значительно слабее и как следствие имеет положительный заряд. А положительные и отрицательные заряды, как известно, притягиваются, таким нехитрым образом и возникает водородная связь.
Связь металлов
Какая химическая связь характерна для металлов? У этих веществ есть свой собственный тип химической связи – атомы всех металлов расположены не абы как, а определенным образом, порядок их расположения называется кристаллической решеткой. Электроны различных атомов образуют общее электронное облако, при этом они слабо взаимодействуют друг с другом.
Так выглядит металлическая химическая связь.
В качестве примера металлической химической связи могут выступать любые металлы: натрий, железо, цинк и так далее.
Как определить вид связи
В зависимости от веществ, принимающих в ней участие, если метал и неметалл, то связь ионная, если два метала, то металлическая, если два неметалла то ковалентная.
Свойства связей
Чтобы провести сравнение разных химических реакций используются разные количественные характеристики, такие как:
Разберем их подробнее.
Длина связи – равновесное расстояние между ядрами атомов, которые соединены химической связью. Обычно измеряется экспериментально.
Энергия химической связи определяет ее прочность. В данном случае под энергией подразумевается усилие, необходимое, для того, чтобы разорвать химическую связь и разъединить атомы.
Полярность химической связи показывает, насколько электронная плотность смещена к одному из атомов. Способность атомов смещать к себе электронную плотность или говоря простым языком «тянуть одеяло на себя» в химии называют электроотрицательностью.
Порядок химической связи (другими словами кратность химической связи) – это число электронных пар, вступающих в химическую связь. Порядок может быть, как целым, так и дробным, чем он выше, тем большее число электронов осуществляют химическую связь и тем труднее ее разорвать.
Видео
И в завершение познавательное видео об разных видах химической связи.
Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika1983@gmail.com или в Фейсбук, с уважением автор.
Похожие посты:
Один комментарий
Для такой коротенькой статьи многовато мелких неточностей. Если трудно пересказать всего лишь школьный учебник, то хотя бы перепишите его один в один. Но тогда в чем ваша роль как популяризатора науки на сайте? В разделе математика у вас значительно выше процентное содержание интересных и более качественных статей. За что вы так невзлюбили химию?
Что мы подразумеваем под видами химической связи
Ключевые слова конспекта. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая.
Силы, которые удерживают атомы в молекулах, называются химическими связями.
Образование химической связи происходит в том случае, если этот процесс сопровождается выигрышем энергии. Эта энергия возникает, если каждый атом, образующий химическую связь, получает устойчивую электронную конфигурацию.
По способу образования и существования химическая связь может быть ковалентной (полярной, неполярной), ионной, металлической.
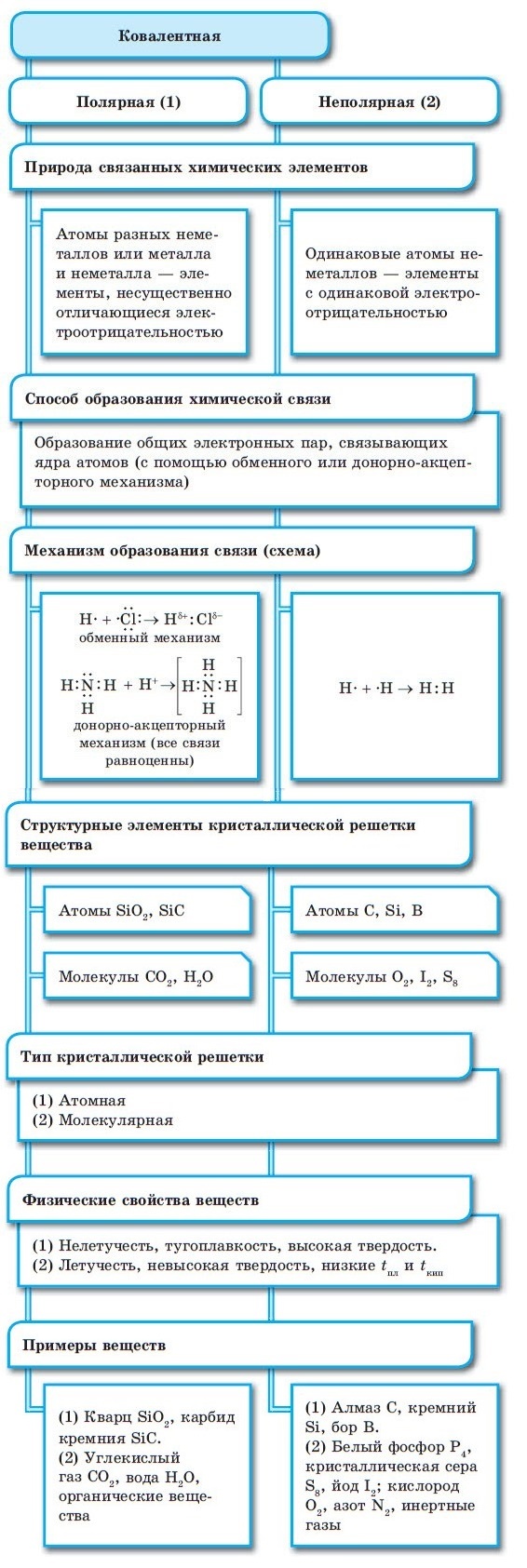
Ковалентная химическая связь
■ Ковалентная химическая связь — это связь, возникающая между атомами путем образования общих электронных пар за счет неспаренных электронов.
Внешние уровни большинства элементов периодической системы (кроме благородных газов) содержат неспаренные электроны, то есть являются незавершенными. В процессе химического взаимодействия атомы стремятся завершить свой внешний электронный уровень.
Таким образом, атом водорода в химических реакциях стремится завершить свой внешний 1 s-уровень одним s-электроном. При сближении двух атомов водорода происходит усиление притяжения электронов одного атома к ядру другого атома. Под действием этой силы расстояния между ядрами атомов сокращаются и в результате их электронные орбитали перекрывают друг друга, создавая общую электронную орбиталь — молекулярную. Электроны каждого из атомов водорода через область перекрывания орбиталей мигрируют от одного атома к другому, то есть образуют общую электронную пару. Ядра будут сближаться до тех пор, пока нарастающие силы отталкивания одноименных зарядов не уравновесят силы притяжения.
Переход электронов с атомной орбитали на молекулярную сопровождается снижением энергии системы (более выгодное энергетическое состояние) и образованием химической связи:
Подобным образом образуются общие электронные пары при взаимодействии атомов р-элементов. Так образуются все двухатомные молекулы простых веществ. При образовании F2 и Cl2 перекрываются по одной р-орбитали от каждого из атомов (образуется одинарная связь), а при взаимодействии атомов азота перекрываются по три р-орбитали от каждого и в молекуле азота N2 образуется тройная связь.
Таким образом, на внешней орбитали атом хлора содержит один неспаренный р-электрон. Взаимодействие двух атомов хлора будет происходить по следующей схеме:
На внешней орбитали атома азота находятся 3 неспаренных р-электрона. Взаимодействие двух атомов азота будет происходить по следующей схеме:
Прочность связей в молекуле определяется количеством общих электронных пар у ее атомов. Двойная связь прочнее одинарной, тройная — прочнее двойной.
С увеличением количества связей между атомами сокращается расстояние между ядрами атомов, которое называют длиной связи, и увеличивается количество энергии, необходимое для разрыва связи, которое называется энергией связи. Например, в молекуле фтора связь одинарная, ее длина составляет 1,42 нм (1 нм = 10 –9 м), а в молекуле азота связь тройная, ее длина — 0,11 нм. Энергия связи в молекуле азота в 7 раз превышает энергию связи в молекуле фтора.
При взаимодействии атома водорода с атомом хлора оба атома будут стремиться завершить свои внешние энергетические уровни: водород — 1 s-уровень и хлор — 3р-уровень. В результате их сближения происходит перекрывание 1 s-орбитали атома водорода и 3р-орбитали атома хлора, а из соответствующих неспаренных электронов формируется общая электронная пара:
В молекулах Н2 и HCl область перекрывания орбиталей атомов водорода расположена в одной плоскости — на прямой, соединяющей центры атомных ядер. Такая связь называется σ-связью (сигма-связью):
Однако если в молекуле формируется двойная связь (с участием двух электронных орбиталей), то одна связь будет σ-связью, а вторая будет образована между орбиталями, расположенными параллельно друг другу. Параллельные орбитали перекроются с образованием двух общих участков, расположенных сверху и снизу от линии, соединяющей центры атомов.
Химическая связь, образующаяся в результате бокового перекрывания орбиталей — в двух местах, называется π-связью (пи-связью):
При образовании ковалентной связи меду атомами с одинаковой электроотрицательностью (Н2, F2, O2, N2) общая электронная пара будет располагаться на одинаковом расстоянии от атомных ядер. При этом общие электронные пары принадлежат в равной степени обоим атомам одновременно, и ни на одном из атомов не будет избыточного отрицательного заряда, который несут на себе электроны. Такой вид ковалентной связи называется неполярной.
■ Ковалентная неполярная связь — вид химической связи, образующийся между атомами с одинаковой электроотрицательностью.
В случае, когда электроотрицательности элементов, вступающих во взаимодействие, не равны, но близки по значению, общая электронная пара смещается в сторону элемента с большей электроотрицательностью. При этом на нем образуется частичный отрицательный заряд (за счет отрицательно заряженных электронов):
В результате на атомах соединения образуются частичные заряды Н +0,18 и Cl –0,18 ; а в молекуле возникают два полюса — положительный и отрицательный. Такую ковалентную связь называют полярной.
■ Ковалентная полярная связь — вид ковалентной связи, образующейся при взаимодействии атомов, электроотрицательность которых отличается незначительно.
Образовавшийся частичный заряд на атомах в молекуле обозначают греческой буквой 8 (дельта), а направление смещения электронной пары — стрелкой:
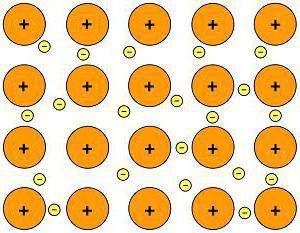
Ионная химическая связь
В случае химического взаимодействия между атомами, электроотрицательность которых резко отличается (например, между металлами и неметаллами), происходит почти полное смещение электронных облаков к атому с большей электроотрицательностью. При этом, поскольку заряд ядра атома имеет положительное значение, атом, который почти полностью отдал свои валентные электроны, превращается в положительно заряженную частицу — положительный ион, или катион. Атом, получивший электроны, превращается в отрицательно заряженную частицу — отрицательный ион, или анион:
Ион — это одноатомная или многоатомная отрицательно либо положительно заряженная частица, в которую превращается атом в результате потери или присоединения электронов.
Между разноименно заряженными ионами при их сближении возникают силы электростатического притяжения — положительно и отрицательно заряженные ионы сближаются, образуя молекулу вещества.
■ Ионная химическая связь — это связь, образующаяся между ионами за счет сил электростатического притяжения.
Процесс присоединения электронов в ходе химических взаимодействий атомами с большей электроотрицательностью называется восстановлением, а процесс отдачи электронов атомами с меньшей электроотрицательностью — окислением.
Схему образования ионной связи между атомами натрия и хлора можно представить следующим образом:
Ионная химическая связь присутствует в оксидах, гидроксидах и гидридах щелочных и щелочноземельных металлов, в солях, а также в соединениях металлов с галогенами.
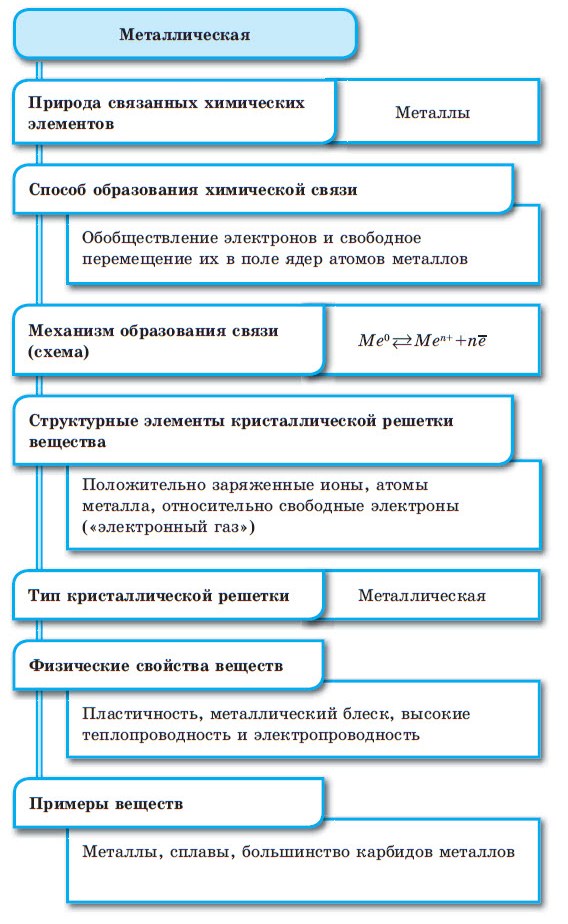
Металлическая связь
Между атомами металлов возникает особый вид химической связи, которая называется металлической. Образование этой связи обусловлено тремя особенностями строения атомов металлов:
При сближении атомов металлов происходит перекрытие их свободных орбиталей, и валентные электроны получают возможность перемещаться на близкие по значениям энергии орбитали соседних атомов. Атом, теряющий электрон, превращается в ион. Таким образом, в металле формируется совокупность электронов, свободно перемещающихся между ионами. Притягиваясь к положительным ионам металла, электроны восстанавливают их, а затем снова отрываются, переходя к другим ионам. Такой процесс превращения атомов в ионы и обратно происходит в металлах непрерывно. Частицы, из которых состоят металлы, называют атом-ионами.
■ Металлическая связь — это связь, образующаяся между атом-ионами в металлах и сплавах посредством постоянного перемещения между ними валентных электронов:
Конспект урока «Химическая связь: ковалентная, ионная, металлическая».