Что можно сказать о молекулах воды и льда
Что можно сказать о молекулах воды и льда
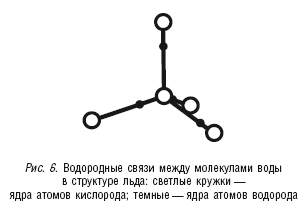
Образование льда – это самое наглядное проявление водородных связей (рис. 6).
Слово «кристалл» в переводе с греческого означает «лед». Во времена Римской империи в Альпах прозрачный хрусталь был принят за окаменевший лед, откуда и произошло его название – горный хрусталь, то есть горный лед.
В результате рентгенографического изучения структуры льда была установлена его тетраэдрическая структура: каждый атом кислорода связан водородными связями с четырьмя другими атомами кислорода. Эти четыре атома, соответствующие четырем молекулам воды, образуют как бы элементарные ячейки, из которых и выстраивается ажурная решетка кристаллического льда (рис. 7).
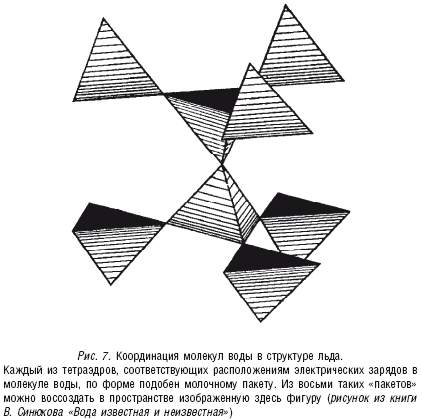
Такая картина (см. рис. 7) полного сохранения четверной координации (тетраэдрической структуры) наблюдается только при очень низких температурах (-183 °C), а при более высоких температурах (но отрицательных) наблюдается небольшое искажение ажурной конфигурации тетраэдрического типа тепловым движением некоторых молекул воды.
Одно из главных условий структуры льда – строгая направленность водородных связей, а отклонение от линейности приводит к резкому их ослаблению, равносильному разрыву.
Посмотрим, как происходит таяние льда. При температуре 0 °C жесткие связи между молекулами воды начинают разрываться (тепловое движение молекул воды преодолевает водородные связи), и кристаллическая структура льда, естественно, начинает разрушаться. Но водородные связи между молекулами воды все же остаются, хотя уже и неупорядоченные. Можно сказать так, что долговременных водородных связей между молекулами воды в жидкой фазе не существует, каждая из связей кратковременна, но в любой момент абсолютное большинство молекул воды связаны между собой водородными связями. Таким образом, при таянии льда в воду переходят те молекулы, у которых ослабли водородные связи, и они попросту отрываются от кристаллической решетки льда и приобретают подвижность. От структуры льда в этих молекулах не остается ровным счетом ничего. Но в то же время жидкая вода остается такой субстанцией, которая имеет структуру в виде подвижных водородных связей (с быстрой передислокацией этих связей от одной молекулы воды к другой). И эта структура присуща ей по причине особого устройства ее молекул. Но это обстоятельство не дает нам оснований манипулировать термином «структурированная вода», подразумевая под ним неким образом искусственно создаваемую структуру жидкой воды (ту же талую воду, получаемую при размораживании льда), так как в противном случае мы должны будем признать возможность существования неструктурированной жидкой воды, какой в природе просто нет. Неструктурированной вода может быть только в газообразном состоянии. Каждая молекула воды имеет водородные связи с четырьмя ближайшими своими соседями. Особенности этих связей в жидкой воде таковы, что они могут легче изогнуться, чем разорваться. Кроме того, эти связи создают некоторую ажурность в структуре жидкой воды, что не дает молекулам воды плотно упаковываться, наподобие бильярдных шаров. Но остается ли в жидкой воде хотя бы в какой-то мере льдоподобная структура? На этот вопрос можно уверенно ответить: нет, не остается.
А теперь рассмотрим несколько примеров, связанных со льдом и с его кристаллической структурой.
Пример первый. О наступлении морозов мы узнаем не только по термометру или по прогнозу погоды, но и по замерзшим лужам. А более любопытные при этом еще и пытаются выяснить, как это на поверхности грязной лужи образуется такой прозрачный лед?
Пример второй. Эскимосы при приготовлении питьевой воды берут морской лед, прекрасно понимая, что получат из него пресную воду. Почему?
И третий пример. В Японии во время зимних праздников создают ледяные скульптуры. Они прозрачны, как и подобает быть льду. Все попытки японцев получить цветной лед не увенчались успехом, так как ввести в кристаллическую решетку льда вещества-красители практически невозможно. Кристаллы льда не допускают внутрь себя каких-либо других молекул, кроме молекул воды. Поэтому становится прозрачным и лед, образовывающийся на поверхности грязной лужи. Поэтому и лед, образующийся из морской воды, вытесняет из себя все минеральные соли, имеющиеся в ней. И естественно, что из такого льда получается пресная вода. В наше время на этом принципе строятся опреснители морской воды. Но когда-то даже Ломоносов ошибался, полагая, что пресные льды Ледовитого океана имеют речное происхождение.
Приведенные примеры показывают нам, что льдоподобная структура воды прежде всего не допускает нахождения в кристаллах льда никаких иных молекул, кроме молекул воды. Хорошо это или плохо с точки зрения физиологической роли воды в нашем организме? Кому-то может показаться, что это очень хорошо, что вода в организме будет находиться в исключительно чистом состоянии. Но наш организм не является просто сосудом для хранения такой воды. Он больше похож на огромную химическую лабораторию, где одновременно протекают тысячи химических реакций, и протекают они в водных растворах. И одной из основных функций воды в нашем организме является функция растворителя. Она растворяет все полезные вещества пищи, чтобы организм мог обеспечить себя и строительными, и энергетическими материалами, она же растворяет и выводит из организма все ненужные ему вещества, которые мы обычно называем шлаками, чтобы содержать организм в чистоте. Так может ли с этой ролью первоклассного растворителя справиться льдоподобная вода, которая не допускает в свои структуры никакие другие вещества? Очевидно, что нет.
Но каково координационное число для воды? Вода представляет собой жидкость, и поэтому у нее нет такой регулярной и упорядоченной структуры, как у кристаллов льда, и расположение всех ее молекул с течением времени постепенно меняется. Однако, основываясь на усредненных данных рентгеновских измерений, можно определить так называемую функцию радиального распределения. Эта функция показывает, что координационное число для жидкой воды равняется 4,4. Иными словами, в обычной воде каждая молекула окружена в среднем 4,4 другими молекулами. Это обстоятельство и играет решающую роль – в результате у воды структура оказывается более плотной, чем у льда. Поэтому, в сравнении с водой, кристаллическая структура льда, для которой координационное число равно четырем, и в самом деле имеет больше незаполненных промежутков, чем вода. Из-за этого лед и становится легче воды.
Только что мы выяснили, что и лед, и вода обладают структурой. Но если у льда наблюдается картина полного сохранения всех четырех водородных связей, то с повышением температуры тепловое движение молекул приводит к ослаблению и разрыву водородных связей, и структура льда разрушается – образуется жидкая вода, в которой молекулы тоже подвержены водородным связям, но не столь жестко, как в структуре льда. То есть изо льда в воду переходят те молекулы, тепловое движение которых превысило водородные связи, и они попросту отрываются от кристаллической решетки льда и приобретают подвижность. Все здесь предельно ясно: вода из одного фазового состояния (твердого) переходит в другое (жидкое), и граница этого перехода – 0 °C.
Но что же тогда нам следует понимать под термином, как пишет Ю. Андреев, «единообразно структурированной воды»? А многие авторы так и вообще называют воду, образовавшуюся после таяния льда, «льдоподобной».
Нигде вблизи льда мы не найдем воду с меньшей плотностью – везде плотность воды будет одинаковой. Это говорит нам о том, что на границе лед – вода происходит четкое разделение двух фазовых состояний воды. Но если бы при таянии льда в воде оставались бы еще и какие-то льдоподобные структуры, допустим, мелкие кристаллы льда, то и плотность воды в прилегающей ко льду зоне была бы немного меньше плотности остальной воды. Мы же такого явления не наблюдаем, а следовательно, в воде, образующейся после таяния льда – а это и есть в прямом смысле талая вода, – нет никакой льдоподобной воды. Многие же авторы, пишущие о талой воде, объясняют ее особые свойства именно льдоподобной структурой такой воды, а Ю. Андреев еще и добавляет, что это «единообразно структурированная вода».
К интересным выводам пришли ученые Сибирского отделения АН СССР В. Корсунский и Ю. Неберухин. В статье «Согласуется ли представление о льдоподобном строении воды с ее радиальной функцией распределения?» они отмечают, что выполненные ими расчеты показывают принципиальные различия распределений межмолекулярных расстояний в жидкой воде и в кристаллическом льду. Полученные результаты свидетельствуют о существенных отличиях в распределении непрерывных сеток водородных связей воды и решетки льда. Делается вывод, что льдоподобная конфигурация в жидкой воде реализуется не за счет сохранения льдоподобного каркаса, а осуществляется построениями случайной сетки водородных связей. Выполненные расчеты не подтвердили наличия в жидкой воде межмолекулярных расстояний, характерных для кристаллической решетки льда.
В итоге можно сказать, что молекулы воды в твердой фазе (лед) жестко связаны между собой водородными связями, а в жидкой фазе эти связи уже не стабильны, они постоянно изменяются, но тем не менее они ситуативно обеспечивают связь каждой молекулы с соседними молекулами, поэтому вода и называется ассоциативной жидкостью. Но ничего льдоподобного в жидкой воде нет, и никакую заданную структуру жидкой воде нельзя придать, можно лишь частично или даже полностью разорвать водородные связи между молекулами воды, переведя ее в газообразную фазу. (В скобках скажу, что в Одессе усиленно рекламируется способ активации воды и придания ей некой структуры с помощью пластины, изготовленной из камня, по внешнему виду похожего на ракушечник. Предлагается поставить на эту пластину банку с водой на несколько часов, и в результате якобы получится структурированная вода, которая может излечить нас от многих болезней. Только достаточно наивный человек может поверить в такую легенду.).
Точно так же и в книге Б. Кристофера «Загадки Земли», главу из которой под названием «Живая вода» опубликовал журнал «Свет» (1990. № 6), нечто неопределенное говорится и о структуре воды, и о влиянии такой структурированной воды на долголетие. Не имея возможности познакомить читателей с полным текстом этой главы, я процитирую лишь небольшой отрывок.
«Свойства воды столь странны и таинственны, что каждый день мы узнаем что-то новое о ее поведении и вписываем в историю науки необычайные сюжеты. Заинтригованный древними преданиями о ключах с живой водой в местечке Хунзакут (на территории нынешнего Пакистана, где проживает много долгожителей. – Примеч. Н. Д.), румынский естествоиспытатель Генри Коанда в тридцатые годы предпринял ряд поездок к этим источникам. Как эксперт по водным ресурсам, он пытался разгадать секрет того, почему вода обладает активностью и исцеляет разные недуги. Целебные свойства воды он прежде всего связал с ее молекулярной структурой, считая, что даже в двух источниках мало общего по составу. Коанда со всем тщанием изучил жизненные соки снежинки и убедился, что это важное свойство исчезает, как только нарушается структура воды. И напротив, чем длительнее жила снежинка, тем она была полезнее для организма и тем было больше сродства с жизненными соками человека, постоянно употреблявшего этот чудесный напиток. Подобная жидкость прибавляла людям силу, долголетие.
Ученый обнаружил, что вода, в которой образуются долгоживущие снежинки, делает чудеса не только в Хунзакуте. Во время своих путешествий в Грузию, Перу, предгорья Тибета он нашел прямую связь между качеством питьевой воды и продолжительностью жизни больших групп населения. Правда, Коанда еще не в состоянии объяснить, почему ледовая вода удлиняет человеческий век».
В приведенной цитате меня удивили два момента. Первый: что исследователь, не задумываясь и не имея на то доказательств, взял да и связал целебные свойства воды прежде всего с ее молекулярной структурой. И далее – второй момент – этот исследователь говорит, что он находит прямую связь между качеством питьевой воды и продолжительностью жизни больших групп населения в определенных районах, в том числе и в Хунзакуте, хотя он и не в состоянии объяснить, в чем заключается это качество, а также «почему ледовая вода удлиняет человеческий век». Под качеством воды этот исследователь понимает всего лишь такую воду, «в которой образуются долгоживущие снежинки». Что следует понимать под термином «долгоживущие снежинки» – трудно сказать. Нам известно лишь то, что при таянии снежинки дают мягкую воду, а именно таковой и является ледовая вода, но о жесткости воды и тем более о содержании в воде ионов кальция этот исследователь не говорит ни слова. И в результате структура снежинки (замерзшей воды) была автоматически и бездоказательно перенесена на воду, получающуюся при таянии льда, и в этом виделась причина долголетия людей, проживающих в тех районах, где наблюдается много долгожителей. Из 1-й главы мы уже знаем, что районы долгожительства имеют воду с низким содержанием кальция. Именно этот фактор способствует долголетию людей. А идею Коанды об особой структуре ледовой воды, поданную им уже более 60 лет тому назад, никто за это время не только не доказал, но и не показал, как же ведет себя особо структурированная вода в организме человека, если она вообще такая в нем имеется, а тем более, как такая вода способствует долголетию. Но сам термин «структурированности воды» продолжает жить и вводить в заблуждение многих и многих читателей, а в последнее время в некоторых целительных изданиях появилось и продолжение структурированности воды – стали говорить и о структурированной моче, и о структурированной крови, и все так же бездоказательно.
И если мы уже убеждены, что не льдоподобная структура определяет необыкновенные свойства талой воды, тогда что же?
Что можно сказать о молекулах воды и льда
Omnium profecto artium medicina nobilissima.
(Hippocratus)
Из всех наук, безусловно, медицина самая благородная. (Гиппократ)
E-mail: svetodarR@inbox.lv +37129180549 (Латвия) ; +79166848121 (Россия)
Структура воды
В 1910 г. американский физик П. Бриджмен и немецкий исследователь Г. Тамман обнаружили, что лед может образовывать несколько полиморфных кристаллических модификации. Сейчас известно 9 модификаций льда, у них различные кристаллические решетки, различные плотности и температуры плавления. Всем нам хорошо знакомым лед называется «льдом I», другие модификации льда существуют при давлениях, превышающих 2000 ат. Например, лед Ш, образующийся при давлении 2115 ат, тяжелее воды, а лед VI (при давлении около 20 000 ат) плавится при температуре, превышающей 80 °C. В обычных условиях мы можем наблюдать лишь лед I, он и изучен наиболее полно. Ниже речь идет именно о нем.
Каждая молекула воды может образовывать до четырех водородных связей, если вблизи окажется достаточное количество подходящих соседей, причем благодаря свойству кооперативности каждая последующая связь требует для своего образования меньше энергии, поэтому она будет образовываться с большей вероятностью, чем предыдущая.
Во льду все молекулы связаны между собой водородными связями. При этом четыре связи каждой молекулы локально организованы в тетраэдрическую структуру, т.е. четыре близлежащие молекулы располагаются в вершинах трехгранной пирамиды, в центре которой находится пятая молекула воды.
Если забыть о тетраэдрах, то можно увидеть, что молекулярная структура льда состоит из зигзагообразных слоев, причем каждая молекула H2O связана с тремя молекулами своего слоя и одной молекулой соседнего слоя. Количество соседей одной молекулы (в данном случае равное четырем) называется координационным числом и легко измеряется рентгеноструктурным методом. Как видим, ажурная сеть водородных связей превращает молекулярную структуру льда в рыхлую конструкцию с большим количеством пустот.
Если очень сдавить лед I, то он перейдет в другие кристаллические формы, и хотя структура его несколько изменится, но основные элементы тетраэдрической конструкции сохранятся. При умеренных давлениях (лед II, VI и IX) часть водородных связей выходит из тетраэдрической структуры (благодаря чему лед становится несколько плотнее), но любые четыре ближайшие атома кислорода по-прежнему объединяются водородными связями. Даже при очень больших давлениях (лед VIII и VII) локально сохраняется тетраэдрическая структура.
Впервые молекулярную структуру льда установил в начале нашего века английский ученый Уильям Брэгг, разработавший рентгеноструктурный метод анализа кристаллов. Он обнаружил, что каждая молекула H2O во льду окружена четырьмя другими молекулами. Но он смог исследовать именно молекулярную структуру льда, установить же, как в этой структуре располагаются атомы кислорода и водорода, ни Брэгг да и никто другой в то время не могли. Брэгг пользовался рентгеноструктурным методом, который в то время позволял наблюдать лишь сравнительно крупные атомы, такие, как кислород или кремний. Небольшие атомы вроде водорода не видны при рентгеноструктурном анализе. Лишь в конце 40-х годов XX века, когда появились новые, более чувствительные спектроскопические методы, удалось установить расположение атомов водорода в структуре льда.
Однако еще в 1932 г. ученик Брэгга профессор Бернал смог чисто умозрительно понять, как должны располагаться в молекулярной структуре льда атомы кислорода и водорода.
Как видим, молекулярная жизнь льда довольно динамична. Но это касается только атомов водорода атомы кислорода прочно сидят на своих местах и расстояние в каждой паре O-O сохраняется неизменным и равным 2,76 A.
Очевидно, что непоседливость атомов водорода безусловно должна влиять на электрические и диэлектрические свойства льда. Лед обладает довольно высокой электропроводностью. Возможно, эта особенность льда объясняется тем, что в присутствии внешнего электрического поля перескоки атомов водорода становятся более направленными.
Теперь перейдем к воде в жидком состоянии. Современное понимание молекулярной структуры воды ведет свою историю со статьи английских ученых Бернала и Фаулера, которая появилась в 1933 г. в августовском номере только что созданного международного журнала по химической физике Journal of Chemical Physics. Эта статья остается одной из самых замечательных вех на тернистом пути познания природы.
Анализируя природу воды, Бернал много времени потратил на изучение льда. Он был уже близок к той теории льда, о которой мы говорили выше. Но сама по себе теория льда, не способная перейти в теорию воды, особой ценности не представляет. А вот с водой все по-прежнему оставалось неясно.
Позднее это предположение было подтверждено рентгеноструктурным анализом, с помощью которого удалось установить, что так называемое «координационное число» воды (т.е. среднее число соседей любой молекулы) равно 4,4. Так как координационное число льда равно 4, то число соседей «среднестатистической» молекулы H2O при переходе из твердого в жидкое состояние возрастает лишь на 0,4 соседа. Следовательно, из каждых 10 молекул воды 8 по-прежнему окружены четырьмя соседями, а около двух других появятся две новые молекулы.
Если же вспомнить, что, во-первых, лед также имеет тетраэдрическую структуру и, во-вторых, что плотность льда и воды отличаются на 9%, то легко понять уверенность Бернала и Фаулера в том, что структура льда подобна структуре тридимита, а структура воды подобна структуре кварца. Далеко не все детали их теории выдержали испытание временем, позднее появились более изощренные теории, но их статья в Journal of Chemical Physics остается одной из наиболее важных вех на теоретическом пути познания воды.
Как это часто бывает, теория Бернала-Фаулера оказалась верной лишь в своей методологической части, а многие ее детали не подтвердились дальнейшими экспериментами. В частности, никаких кварцеподобных структур обнаружить в жидкой воде не удалось. А вот представление о воде как о жидкости с сильно развитым ажурным каркасом находило все больше и больше подтверждений.
Отдельная молекула воды не может постепенно накапливать энергию, чтобы по достижении определенного энергетического уровня оторваться от соседей. Воспользовавшись известным физическим лексиконом, можно сказать, что каждая молекула льда сидит в глубокой энергетической яме с совершенно отвесными краями. Выскочить из такой ямы очень трудно, а если выскочившая молекула «оступится», она сразу окажется внизу, в структуре идеального льда. Поэтому, во-первых, вероятность разрыва водородных связей мала, а во-вторых освободив из кристаллической структуры всего одну молекулу H2O, лед отдаст сразу довольно большую энергетическую дань кинетическим процессам плавления и тем самым может сохранять значительное число молекул в кристаллической структуре.
Энергетические ямы, в которых находятся другие вещества, имеют иной вид. Между состояниями, соответствующими кристаллу и жидкости, находится целый ряд промежуточных состояний. Поэтому молекулы обычных веществ могут постепенно накапливать энергию, переходя из одной промежуточной ямы в другую. Если же какая-либо молекула потеряет часть энергии, то она окажется не в самом низу ямы, а может задержаться в каком-либо промежуточном состоянии. В результате этого довольно быстро в процесс плавления вовлекаются все молекулы кристалла. Средняя энергия молекул постепенно растет, при этом индивидуальные колебания энергии молекул не слишком велики. Если изобразить плавление обычного кристалла в некоем фазово-энергетическом пространстве, то можно будет увидеть, что при плавлении все молекулы держатся довольно компактной группой. В самом деле, каждая точка такого пространства обозначает энергетический уровень молекул. В начале плавления все точки сольются в одну сплошную точку, соответствующую кристаллическому состоянию. В процессе плавления обычного вещества эта точка поползет вверх, постепенно размываясь и распадаясь на отдельные точки. Потом центральная точка распадется на более мелкие точки, которые, в свою очередь, будут также распадаться, и завершится этот процесс образованием большого, относительно плотного роя точек с центром, соответствующим жидкому состоянию. Картина плавления льда в такой интерпретации будет выглядеть совершенно иначе. Своеобразие энергетического профиля молекул льда позволяет достаточно большому числу молекул H2O во время плавления сохранять кристаллическую гексагональную структуру из водородных связей, в каждый момент времени в процессе плавления фактически участвует лишь небольшое количество молекул воды. В начале плавления все молекулы «сидят» на энергетическом уровне, соответствующем состоянию льда. По мере нагревания льда отдельные молекулы вырываются из кристаллической структуры и сразу оказываются на энергетическом уровне молекул без водородных связей. Между этими двумя уровнями идет непрерывный обмен, часть «жидких» молекул встраивается в гексагональную структуру, из которой за это же время какая-то часть молекул освобождается. По мере нагревания льда число уходящих из ледяной структуры молекул растет, а число возвращающихся падает. Но даже после полного завершения плавления достаточно большая часть водородных связей, существовавших во льду, сохраняется и в воде.
Л. Полинг в 1952 г. высказал предположение, что структура воды подобна структуре клатратных гидратов типа Cl2•10H2O. Эйринг выдвинул теорию значащих структур, которая предполагает, что в воде существует две кристаллоподобные структуры: лед I и лед III. Водородные связи в структуре льда III несколько сжаты и слегка изогнуты, поэтому лед этот на 20% плотнее льда I.
Г. Намети и X. Шерага предположили, что каждая молекула воды может находиться в одном из пяти допустимых энергетических состояний, определяемых тем, сколько водородных связей она образует (0, 1, 2, 3 или 4). Предполагается, что молекулы собираются в льдоподобные «рои». Проделав обычный для статистической механики анализ, Намети и Шерага нашли количество молекул воды в отдельных роях, образующих 4, 3 и 2 водородные связи. Полученный таким образом молярный объем системы имеет минимум при 4 °C, другие параметры также неплохо соответствуют экспериментальным результатам. Однако теория Намет и Шерага, как и двухструктурная модель, противоречит целому ряду спектроскопических данных. Это общий недостаток всех теории, предполагающих существование четко различающихся структур в воде. В реальной воде, по-видимому существует широкий и непрерывный спектр различных молекулярных структур.
Все теории (здесь мы упомянули лишь некоторые) более или менее согласуются с наблюдаемыми экспериментальными данными, но для каждой из них рано или поздно обнаруживались факты, которые они не могли объяснить. Это, разумеется, не означает, что теории неверны. Каждая из них представляла определенную степень приближения к истинной реальной картине физического состояния воды и работала на будущую окончательную теорию.
Обобщая результаты многочисленных компьютерных экспериментов, можно сказать, что топологию молекулярной структуры воды нельзя трактовать в виде какой-либо гексагональной структуры льда со случайно разорванными водородными связями. Более того, эта структура представляет собой единое целое в любом объеме воды. Машинные эксперименты показали, что сеть водородных связей находится выше «порога критической перколяции». Это означает, что в любом объеме воды всегда найдется по крайней мере одна сплошная цепочка из водородных связей, пронизывающая весь объем воды.
Как же теперь, в свете результатов компьютерных экспериментов, можно представить физическую природу воды? На молекулярном уровне вода, по-видимому, представляет собой случайным образом организованную трехмерную сеть водородных связей. Локально эта сеть стремится к тетраэдрической конфигурации. Это означает, что ближайшие соседи среднестатистической молекулы воды в основном располагаются в вершинах четырехгранной пирамиды, окружающей молекулу воды. Сеть содержит значительное число сильно напряженных водородных связей, причем именно эти связи играют фундаментальную роль в возникновении особых аномальных свойств воды. Любая молекула воды, связи которой достаточно напряжены, может быстро изменить все свое ближайшее окружение, переключив свои напряженные связи на новых соседей. Все это приводит к тому, что общая топология всей сети водородных связей воды чрезвычайно изменчива и разнообразна. В процессе плавления льда четкая, но рыхлая тетраэдрическая структура заменяется менее определенной, но более компактной сетью водородных связей. Увеличение плотности происходит за счет образования более компактных локальных структур (например, переход к пятиугольникам из водородных связей) и за счет искривления водородных связей. При нагревании талой воды переход к более компактным структурам доминирует до 4 °C, после которого превалируют процессы, связанные с обычным термическим расширением.
Структура жидкости
Источник